活動報告
研究報告書:平成24-26年度
計画研究班
平成26年度
A01-2 竹安・脇田
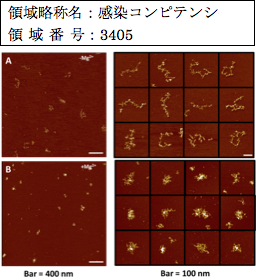
原子間力顕微鏡AFMの技術により各種感染体のゲノム構造と動態を“まるごと”みて明らかにし、感染体ゲノム構造とその発現場としての真核細胞クロマチン/核内構造との相互作用を明らかにすることを目的としている。C型肝炎ウイルスは1本鎖RNAをゲノムとしており、そのゲノムを可視化するために「1本鎖RNAを如何に基板(通常は劈開した雲母片)上に吸着させ」、さらに「1本鎖RNAの本来の高次構造を如何に保つか」といった技術的な課題を解決し、「9Kbの1本鎖HCV RNAの構造解析」を行った(Gilmore JL et al.,
J. Nanomed. Nanotechnol., 2014)。1本鎖RNA (Poly(A)-RNA、18SrRNA、28SrRNA、9kb-HCV genome RNA)は分子内でワトソン・クリック型塩基対を形成し、多くの複雑なループ構造をとるため、RNAの全長を計測することはできない。一方、AFM解析で求めた体積は塩基長に比例することから、「体積測定がRNAを特定する」また「特定の分子内ループの存在はAFM画像から検出できる」ことが分かった。(領域内共同研究成果)
平成25年度
A01-3 藤田
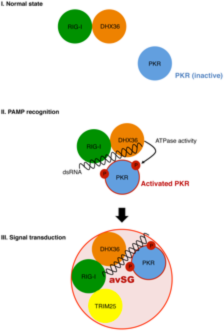
ウイルス感染細胞ではウイルスの二重鎖RNAがタンパク質キナーゼPKRを活性化し、その結果、翻訳開始因子eIF2aの51番目のスレオニンが、リン酸化されることによってanti-viral stress granule (avSG)が誘導される。我々はRNAヘリカーゼの1つであり、二重鎖RNA結合能を有するDHX36が恒常的にRIG-Iと複合体を形成していること、ウイルス感染細胞ではウイルスの二重鎖RNAを介してRIG-I/DHX36に加えてPKRもその複合体に加わり、PKRの活性化が促進され、効率的にavSGが形成されることを見出した。重要なことはウイルスRNAがRIG-I/DHX36/PKR複合体を活性化し、その結果avSGが誘導され、その中でRLRがウイルスRNAを効率的に感知するという機構が明らかとなったことである。(Yoo JS et al.,
PLoS Pathog., 2014)(公募・米山班との領域内共同研究成果)
A01-3 永田・朴
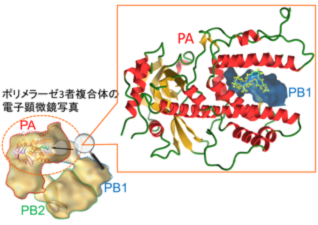
(特許)朴三用、永田恭介、川口敦史、尾林栄治 インフルエンザウイルス由来のRNAポリメラーゼ発現系構築と結晶化及び抗インフルエンザ薬のスクリーニング方法(US8,455,229B2、米国)。インフルエンザウイルスポリメラーゼはPB1、PB2、PAからなる3者複合体である。我々は、PAとPB1の結合部位のX線結晶構造を決定し、PAのC末端が形成するドラゴンの顎に類似したドーム構造内に、PB1のN末端が挿入されることで結合することを明らかにした。この構造は新規フォールドであり、種に依存せず、すべてのウイルス株間で保存されていた。本特許は、この構造をもとに、
in silicoドッキングシミュレーションによる抗ウイルス薬のスクリーニング方法を構築したものである。(領域内共同研究成果)
A01-5 小池
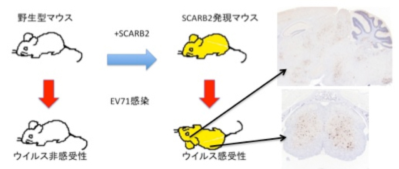
エンテロウイルス71感受性マウスの開発:EV71の研究に適した小動物モデルは存在していなかった。小池班でEV71受容体 SCARB2を同定し、それを発現するトランスジェニック(Tg)マウスを作製した。TgマウスはEV71感受性を獲得し、ヒトと類似の中枢神経感染症を起こすことが判明した。ウイルス受容体が種特異性を決定していることを明らかにした。このマウスモデルはウイルスのトロピズム決定機構を研究する大きな足がかりとなる。(Fujii K et al.,
Proc. Natl. Acad. Sci. U.S.A., 2013)
平成24年度
A01-4 柳
麻疹ウイルスの免疫細胞、上皮細胞への感染は、レセプターが同定されよく理解されているが、神経細胞への感染機構は不明である。麻疹ウイルスFタンパク質(膜融合に関与する)の細胞外領域の特定の変異により構造が不安定化すると、既知のレセプターを発現していない細胞においてもFタンパク質が活性化されて膜融合を起こすようになることを明らかにした。また、このような変異Fタンパク質をもつ組換え麻疹ウイルスは、野生型ウイルスと異なり、ハムスターの脳で広範に伝播する (Shirogane Y et al.,
Nature Commun., 2012; Watanabe S et al., J. Virol., 2013)。これらの知見は、麻疹ウイルスの神経細胞感染の理解と治療法開発に重要な情報を提供する。
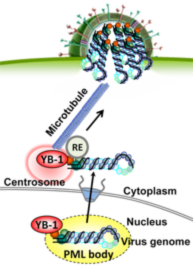
A01-1 永田
複製されたインフルエンザウイルスゲノムは、核外輸送後、細胞膜に輸送されてウイルス粒子に取り込まれる。しかし、ウイルスゲノムの細胞内動態を制御する機能分子は明らかにされていない。我々はその細胞内動態を決定する宿主因子としてYB-1を同定した(Kawaguchi A et al.,
J. Virol., 2012)。YB-1は転写因子として機能し、転写後に宿主mRNAに結合して、スプライシングや翻訳を制御する因子である。YB-1は核内のPMLボディでウイルスゲノムと結合する。核外輸送後、YB-1によってウイルスゲノムは中心体にリクルートされ、微小管依存的に中心体から細胞膜へ輸送されることを見出した。この結果は、上皮組織等でのウイルスゲノムの極性輸送の理解にもつながる。
A01-4 荒瀬
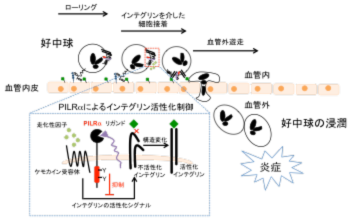
炎症応答は、ウイルス感染等に対する重要な生体防御応答の一つであり、局所への免疫細胞の浸潤等を伴う。しかし、過剰な炎症は臓器障害を引き起こすため、炎症応答は適度に調節されている必要があるが、炎症の調節機構、特に、免疫細胞の局所への浸潤がどのように調節されているかは、まだ十分に明らかにされていない。我々は、好中球等の細胞表面に発現している抑制化レセプターPILRαの機能を明らかにするために、PILRα欠損マウスを樹立して解析した。その結果、PILRαはウイルス感染等によって引き起こされる炎症の強さを制御する分子であることが明らかになった。本研究成果は、ウイルス抵抗性を決定する免疫応答の制御機構の解明に貢献すると期待される(Wang J et al.,
Nat. Immunol., 2013)。
公募研究班
平成26年度
加藤
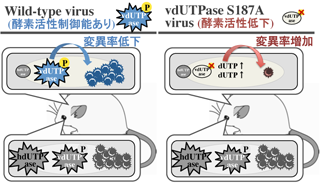
単純ヘルペスウイルス(HSV)は、ウイルス特異的なリン酸化酵素(PK)をコードしており、ウイルス因子や宿主因子をリン酸化し、その機能発現を制御すると考えられてきた。我々は、高感度質量分析計を駆使したリン酸化プロテオーム解析により、HSV感染細胞におけるリン酸化情報を網羅的に解明した。さらに、①HSV PKがviral dUTPase Ser-187をリン酸化し、その酵素活性を亢進することで、宿主dUTPase活性の低い神経系組織において、dUTPae活性を補填し、正確にHSVゲノムを複製すること、②本リン酸化現象は、マウスモデルにおける神経病原性(中枢神経系の破壊能)を特異的に司ることを解明した(Kato A et al.,
J. Virol., 2014)。本知見は、ヘルペス脳炎克服や安全なHSV遺伝子治療ベクター開発の糸口となることが期待される。
松浦
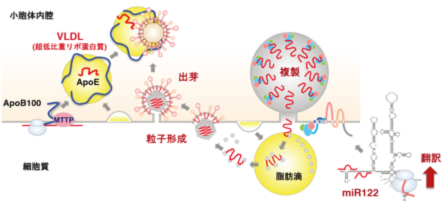
C型肝炎ウイルス(HCV)は肝臓で増殖するが、親和性の決定機構は不明な点が多い。肝臓特異的なマイクロRNAであるmiR-122は、非肝臓細胞ではほとんど検出されない。miR-122を強制発現させた非肝臓細胞株にHCVを接種すると、いくつかの細胞株でゲノム複製が観察されるが、感染性粒子は産生されない。非肝臓細胞株は肝臓細胞に比べて、超低比重リポタンパク質の産生に関与するアポリポタンパク質の発現が有意に低いことから、HCVの肝臓親和性は、マイクロRNAや脂質代謝系によって規定されていることが示唆された(Fukuhara T et al.,
J. Virol., 2012)。次に、α-fetoproteinの発現を指標にして肝機能を保持した細胞株を選択し、ヒト胃癌由来のFU97細胞がmiR-122を強制発現しなくても、肝臓由来のHuh7細胞と同等のHCV感受性を示すことを見いだした。FU97細胞は薬剤やウイルス株に関して、肝臓由来のHuh7細胞とは異なる性状を示すことから、HCVの増殖に関与する新しい宿主因子や新規治療薬の探索への応用が期待される(Shiokawa M et al.,
J. Virol., 2014)。(計画・脇田班との領域内共同研究成果)
平成25年度
野田
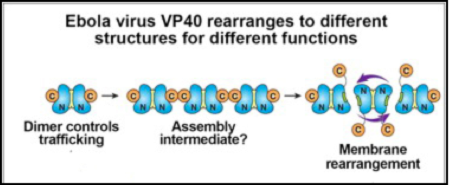
RNAウイルスは、わずか10種類程度のウイルスタンパク質を巧みに利用しウイルス増殖を遂行する。しかし、ウイルスタンパク質にどのように多機能性が包含されるかわかっていない。我々は、エボラウイルス粒子形成におけるVP40タンパク質に関して解析した(Bornholdt ZA, Noda T et al.,
Cell, 2013)。X線結晶構造解析により、N末端を介したdimer形成が脂質膜結合能・細胞表面への輸送能を担うことを明らかにした。また、C末端を介したdimer-dimer相互作用が、ウイルス粒子形成および出芽に重要であることを見出した。さらに、脂質膜結合をミミックした条件において、C末端領域が構造変化を起こしhexamerを形成すること、このhexamerがウイルス粒子を構成することを示した。本成果は、エボラウイルスの粒子形成機構を明らかにしただけでなく、タンパク質が有する多機能性と構造の相関を明らかにしたことで生物学的に重要な意義を持つ。
片平
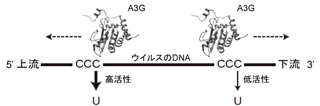
ヒトのAPOBEC3Gタンパク質(A3G)はHIVのDNAに作用し、シトシンをウラシルに変換する事で抗HIV活性を発揮する。NMRシグナルを用いてA3Gの塩基変換反応をリアルタイムでモニタリングしたところ、標的となるシトシンが5’端近くに位置するほど反応が早く進行する事が分かった。A3GのDNAへの非特異的な結合とDNA上におけるスライディングを考慮した解析の結果、A3GがDNA上を上流にスライディングしながら標的シトシンに到達した際の方が、下流にスライディングしながら標的シトシンに到達した際より、塩基変換反応の触媒活性が大きい、とする事で上記の観測結果を合理的に説明できる事が分かった(Furukawa A et al., Angew. Chem. Int. Ed., 2014)(計画・高折班との領域内共同研究成果)。
奥野
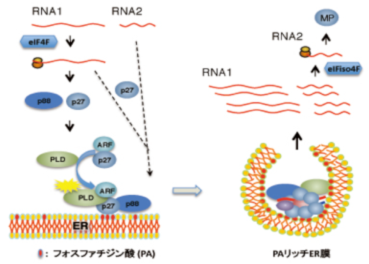
Red clover necrotic mosaic virus(RCNMV)のゲノムはキャップ構造とpoly(A)配列を持たない二分節のRNA1とRNA2からなる。シロイヌナズナを用いた遺伝学的解析からRNA1とRNA2はそれぞれeIF4FとeIFiso4Fという異なった翻訳開始因子を用いて複製酵素タンパク質と細胞間移行タンパク質を翻訳することが分かった。また、RNA複製に必要な宿主因子としてArf1、phospholipase D(PLD)などを同定した(Hyodo K et al.,
J. Virol., 2013)。ウイルス複製タンパク質によりER膜にリクルートされたこれらのタンパク質は、PLDによりリン脂質をフォスファチジン酸に変え膜を改変し、RNA複製工場作ることが分かってきた。RNA2の翻訳活性はRNA複製とリンクしてのみ認められることから、ゲノムRNA間で異なる翻訳、複製機構の解明は、ウイルスと宿主の攻防のさらなる理解に繋がることが期待される。
平成24-26年度研究報告書のグダウンロードはこちらから