研究成果
業績資料(藤田)
概要
ウイルスや細菌などの病原体が感染すると、病原体パターン認識受容体がその感染を認識し、自然免疫応答を惹起する。RNAウイルスの認識に必須の受容体であるRIG-I-like receptors (RLRs)は、ウイルスのRNAを認識することにより活性化し、下流のアダプター分子であるIFN-β promoter stimulator-1を介してI型インターフェロン (IFN)や炎症性サイトカインの産生を誘導する。過剰なI型IFNや炎症性サイトカインの産生は自己免疫疾患の原因となることなどから、RLRシグナルは厳密に制御されているが、その制御機構の全容は明らかではない。今回われわれは、発現クローニング法によりI型IFN産生誘導に関わる新規分子として、Pumilioタンパク質を同定した。ヒトのPumilioタンパク質であるPUM1およびPUM2を過剰発現させると、ニューキャッスル病ウイルス(NDV)感染におけるIFN-βプロモーター活性が上昇し、siRNAを用いてその発現を抑制すると、NDV感染に応答したI型IFN遺伝子の発現が減少した。また、PUM1/2とRLRの相互作用を免疫沈降法にて解析したところ、PUM1/2はlaboratory of genetics and physiology 2 (LGP2)と特異的に相互作用していた。免疫染色法により、Pumilioタンパク質はNDV感染刺激により細胞質で顆粒状の凝集体を形成し、抗ウイルスストレス顆粒に局在していることが明らかとなった。興味深いことに、in vitroにおける生化学的機能解析から、Pumilioタンパク質はLGP2のRNA結合能を上昇させていることが示された。これらのことから、Pumilioタンパク質はLGP2のウイルス感染認識を制御することにより、I型IFN発現制御に関与していることが明らかとなった。
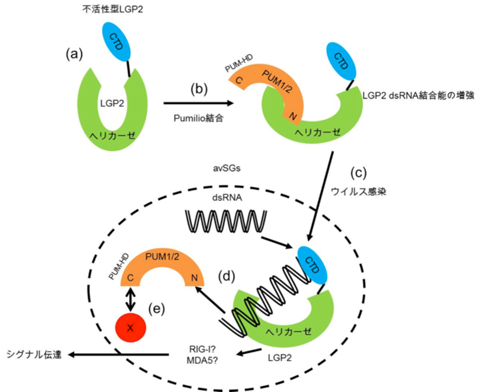
PumilioとLGP2によるウイルスRNA認識モデル
ウイルス非感染時にはLGP2とPumilioは複合体を形成して細胞質に局在しており、Pumilioの結合は、恐らくLGP2の構造変化を引き起こし、RNAを認識しやすい状態にしているものと考えられる(a、b)。ウイルス感染時には、その増殖や複製過程で生じた非自己のウイルスRNAが細胞質に蓄積し、avSGsが形成され、種々の抗ウイルス分子がavSGsに凝集する(c)。ウイルスRNAのLGP2への結合はPumilioの解離を誘導し(d)、LGP2はRIG-IやMDA5を介して下流のアダプター分子IPS-1へシグナルを伝達する(e)。X; PUM-HDを介してPumilioと結合し、avSGsへの局在に必要な未知の分子。

