研究成果
計画研究班A01-7(小柳)
概要
ヒト免疫不全ウイルスI型(HIV-1)はヒト特異的病原性ウイルスであるため、その感染病態を実験動物モデルにおいて再現・解析することはきわめて困難であった。本研究では、重度複合免疫不全マウスであるNOD/SCID/Il2rg-/-マウス(NOGマウス)にヒトCD34陽性造血幹細胞を移植し、ヒト造血能を長期間維持できる"ヒト化マウス"モデルを作製した。これまでの培養細胞を用いた実験から、ヒト細胞は、HIV-1をはじめとするレトロウイルスの複製を強力に阻害するタンパク質(宿主因子)を内在的にコードしていること、その一方でHIV-1は、宿主因子による阻害を免れるためのタンパク質(ウイルス因子)を自身のゲノムにコードしていることが明らかとなってきていた。しかし、HIV-1感染病態を再現できる動物モデルが存在しなかったため、HIV-1感染病態におけるウイルス因子と宿主因子の相互作用の実態はこれまでほとんど明らかとなっていなかった。ヒト化マウスモデルを用いたこれまでの研究から、個体内のHIV-1複製におけるウイルス因子と宿主因子の相克、および、それらと感染病態発現の関連性が明らかとなっている(Sato et al., PLOS Pathog., 2013; Sato et al., J. Virol., 2012; Sato et al., J. Virol., 2010)。本研究では、リバースジェネティクス法を用いて作出した遺伝子改変HIV-1をヒト化マウスモデルに接種して、APOBEC3DとAPOBEC3Fという細胞性タンパク質がHIV-1粒子の中にあると、その多様化・進化を促進させ、感染する細胞種を拡大させる能力があることを明らかにした。これまでの研究から、APOBEC3ファミリータンパク質は、HIV-1ゲノムに変異を挿入することによって強力な抗ウイルスを示す細胞性タンパク質であると考えられていた。しかし本研究により、あるAPOBEC3タンパク質は、感染を拡大させるというウイルスにとって有利な遺伝子変異を引き起こし得ることが、初めて明らかとなった。
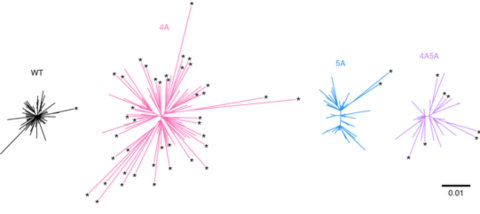
< Figure legend >
Mutation can produce three outcomes in viruses: detrimental, neutral, or beneficial. The first one leads to abrogation of virus replication because of error catastrophe, while the last one lets the virus escape from anti-viral immune system or adapt to the host. Human APOBEC3D, APOBEC3F, and APOBEC3G are cellular cytidine deaminases which cause G-to-A mutations in HIV-1 genome. Here we use a humanized mouse model and demonstrate that endogenous APOBEC3F and APOBEC3G induce G-to-A hypermutation in viral genomes and exert strong anti-HIV-1 activity in vivo. We also reveal that endogenous APOBEC3D and/or APOBEC3F induce viral diversification. Our results suggest that APOBEC3D and APOBEC3F are capable of promoting viral diversification and functional evolution in vivo.

