研究成果
発表論文報告(公募班A02-28杉田)
概要
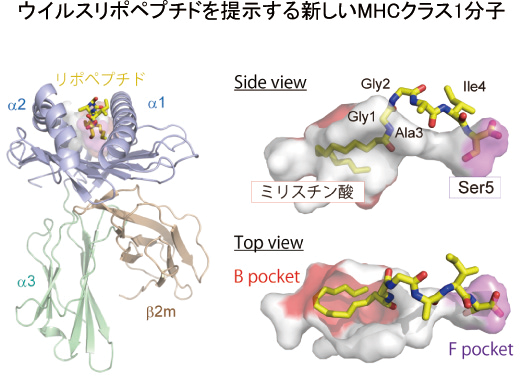
ウイルスは、宿主細胞が持つ様々な酵素反応を利用することにより、感染を成立させる。例えば、HIV/SIVが産生するNefタンパク質は、宿主のミリスチン酸転移酵素の作用により、そのN末端にミリスチン酸を結合する。その結果、Nef蛋白質は細胞膜へのアンカーが可能となり、その特異な免疫抑制機能を発揮する。一方、サルエイズモデルを用いたこれまでの研究成果より、ミリスチン酸修飾を受けたNefタンパク質のN末断片(リポペプチド)を特異的に認識する細胞傷害性T細胞が存在することが分かってきた。すなわちこのT細胞は、ウイルスの病原性発揮の鍵となるNefタンパク質のミリスチン酸付加反応を鋭敏に検知し、感染細胞を排除することのできる重要な免疫反応を担うと考えられる。しかし、リポペプチド抗原がどのようにして細胞傷害性T細胞に提示されるのか、その分子機序は不明であった。
本研究では、このリポペプチド抗原提示を担う新しいタイプのMHCクラス1分子(Mamu-B*098)を同定し、リポペプチドとの詳細な結合様式をX線結晶構造解析によって解明した(図)。興味深いことに、このMHCクラス1分子の抗原結合溝はリポペプチドとの結合に最適化された構造を有しており、これまでMHC クラス1分子に結合すると考えられてきた典型的な長鎖ペプチドを結合しないことが構造学的に強く示唆された。この事実は、「MHCクラス1分子は長鎖ペプチド抗原を提示する」と言う広く受け入れられた既成概念を新たに塗り替えるものであり、一部のMHCクラス1分子はリポペプチド抗原提示を担うように進化してきた可能性が考えられる。また、リポペプチド抗原には変異の導入が困難であることから、免疫逃避が成立しがたく、ウイルスの急所を突く画期的なリポペプチドワクチンの開発が期待される。