| 貫名 信行 (理化学研究所・脳科学総合研究センター・構造神経病理研究チーム)
1.研究の背景
ハンチントン病や遺伝性の脊髄小脳変性症の多くは、その病気の原因遺伝子のCAG塩基配列の繰り返しが異常に伸長することにより、異常に伸長したグルタミン鎖を含む原因遺伝子産物が神経細胞に異常蓄積し、神経細胞死や機能異常を引き起こす疾患である。異常に伸びたグルタミン鎖がその病気の発症に強く関わっていることからポリグルタミン病とまとめて呼ばれている。ポリグルタミン病は遺伝性神経変性疾患では最も多いものの一つである。
一般に中高年に発症するが、ポリグルタミン鎖の長さが長いと若年で発症することからポリグルタミンの長さに依存した神経細胞への毒性がどのようにして生じているかが、その病態を考える上で重要である。近年そのような病態を再現するモデルマウスの解析からポリグルタミン病の神経細胞の核にポリグルタミンを含む蛋白凝集体:核内封入体が形成されることがわかり、これらの病気において凝集体形成が重要な役割を果たしていることが示唆された。このようにポリグルタミン病はその病態が少しずつわかっては来たが、治療法が確立しておらず、遺伝子診断が直接患者さんの治療に結びつかないといった矛盾があり、治療法、発症予防法の確立が急がれていた。
2.研究の概要
われわれはポリグルタミンを発現する細胞モデルを用いて、伸長するポリグルタミンを発現すると異常な凝集体を形成し、シャペロン系がその凝集を抑制しようとするにもかかわらず、凝集抑制がうまくいかないと、細胞の蛋白分解系プロテアソームを阻害して細胞死を引き起こすという機序を明らかにしてきた1-3)。これらの病態の中核にあるのは凝集体形成であり、その凝集体に様々な分子がリクルートされることである4)。プロテアソームの系の障害は様々なシグナルカスケードにも障害を与えると考えられ、実際PKCαにおいても活性化され膜に移行した後の分解が障害されることを示した5)。
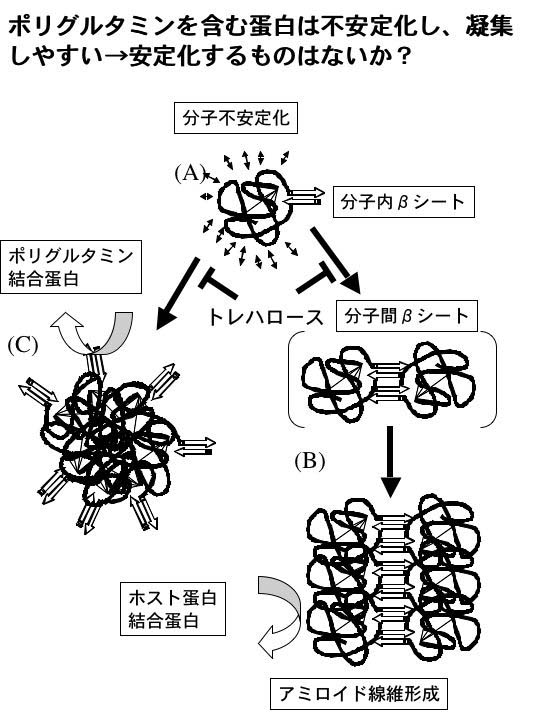
このような病態の解析から、凝集抑制がこの病態を抑えるために必要と考え、最も上流のポリグルタミンを含む蛋白の構造異常の解析を行った。ポリグルタミン鎖を安定性の極めて高い蛋白質で構造も明らかにされている蛋白質の一つであるミオグロビンへ挿入し、ポリグルタミン鎖の構造およびポリグルタミン挿入に伴う(ホスト)蛋白質の構造変化を検討した。その結果変異型ミオグロビンに挿入された伸長したポリグルタミン鎖は分子内ベータシート構造をとっていることが判明した。また、35、50のリピート数をもつミオグロビンは凝集体を形成し始めると分子間ベータシート構造を含んでいることがわかり、またポリグルタミンの伸長に伴いミオグロビンが不安定化することが示された6)。また最も伸長した50リピートのポリグルタミン鎖を持つミオグロビンはアミロイド繊維形成以前におそらくホスト蛋白のアンフォールディングに基づく非繊維性凝集体を形成することも示した。このような非繊維性凝集体はポリグルタミン部分を露出しており、ポリグルタミン結合蛋白をリクルートすると考えられ、ポリグルタミン病共通の病態に強く関わると想定される。一方繊維が形成されるとポリグルタミン部分は繊維内部に入り込むため、表面のホスト蛋白が主として関連分子をリクルートすると考えられる。そこでこの研究で用いた変異ミオグロビンの系を用いて病態の最も上流である凝集体形成を抑える化合物を検索した。(図1)
|
| 図1.(A)ポリグルタミンは伸長するとベータシートを形成する。(B)このベータシートはベータシート間の結合を生じ、繊維を形成する。(C)一方ホスト間の凝集でポリグルタミンを表面に露出した凝集体も形成される。これらの凝集体はホスト結合蛋白、ポリグルタミン結合蛋白をリクルートし、細胞毒性を生ずる。分子不安定化を抑えることによって凝集体形成を抑えられないか。 |
Mb-Q35(35ポリグルタミンを含むミオグロビン)を用いて200あまりの化合物をin vitroで検討したところ、二糖に凝集抑制効果が認められ、その中でもトレハロースが最も強力であった。そこでトレハロースの効果をポリグルタミンが発現した細胞においてみたところ、凝集抑制効果が認められ、トレハロース合成酵素OtsA,Bを発現したところ凝集抑制効果、細胞死抑制効果はシャペロンのHDJ1と同程度に認められた。さらにトレハロースのMb-Q35の不安定性に対する影響を評価したところ、トレハロース存在下でMb-Q35は正常域のQ12(12グルタミンを持つもの)と同程度になることが示され、これらの結果はトレハロースが分子を安定化し、凝集抑制効果があり、その結果細胞死抑制効果が認められたと考えられた。さらにハンチントン病モデルマウスR6/2マウスの飲料水に2%の濃度で投与したところ生存日数の増加(10%程度)、ロタロッドテストなどの機能低下の遅延、病理学的な凝集体形成減少を認めた。以上の結果トレハロースは伸長したポリグルタミンによるホスト蛋白の不安定化を抑え、凝集体形成を抑えることにより発症を遅延させたと考えられた。
3.研究の意義
本研究によって凝集体形成が病態の最も上流にあり、これを抑えることにより、病態の進行を抑えることが可能であることを示された。この抑制効果が完全なものでないことは、より強力な抑制効果のある化合物の探索や、あるいは凝集体分解の促進などが今後の治療法開発にとって必要であることを示唆している。アルツハイマー病、パーキンソン病あるいは筋萎縮性側索硬化症などの神経変性疾患の病態において蛋白のミスフォールディングが注目されている。これらの疾患においても分子安定化による治療の可能性が示唆されたと考える。
文献
1) Wang, G. H., Mitsui, K., Kotliarova, S., Yamashita, A., Nagao, Y.,
Tokuhiro, S., Iwatsubo, T., Kanazawa, I., and Nukina, N. (1999). Caspase
activation during apoptotic cell death induced by expanded polyglutamine
in N2a cells. Neuroreport 10, 2435-2438.
2) Jana, N. R., Tanaka, M., Wang, G., and Nukina, N. (2000). Polyglutamine
length-dependent interaction of Hsp40 and Hsp70 family chaperones with
truncated N-terminal huntingtin: their role in suppression of aggregation
and cellular toxicity. Hum Mol Genet 9, 2009-2018.
3) Jana, N. R., Zemskov, E. A., Wang, G., and Nukina, N. (2001). Altered
proteasomal function due to the expression of polyglutamine-expanded
truncated N-terminal huntingtin induces apoptosis by caspase activation
through mitochondrial cytochrome c release. Hum Mol Genet 10, 1049-1059.
4) Mitsui, K., Nakayama, H., Akagi, T., Nekooki, M., Ohtawa, K., Takio,
K., Hashikawa, T., and Nukina, N. (2002). Purification of polyglutamine
aggregates and identification of elongation factor-1alpha and heat shock
protein 84 as aggregate-interacting proteins. J Neurosci 22, 9267-9277.
5) Zemskov, E. A., and Nukina, N. (2003). Impaired degradation of PKCalpha
by proteasome in a cellular model of Huntington's disease. Neuroreport
14, 1435-1438.
6) Tanaka, M., Morishima, I., Akagi, T., Hashikawa, T., and Nukina,
N. (2001). Intra- and intermolecular beta-pleated sheet formation in
glutamine-repeat inserted myoglobin as a model for polyglutamine diseases.
J Biol Chem 276, 45470-45475.
7) Tanaka, M., Machida, Y., Nishikawa, Y., Akagi, T., Hashikawa, T.,
Fujisawa, T., and Nukina, N. (2003). Expansion of polyglutamine induces
the formation of quasi-aggregate in the early stage of protein fibrillization.
J Biol Chem 278, 34717-34724.
|