低酸素応答プロジェクト
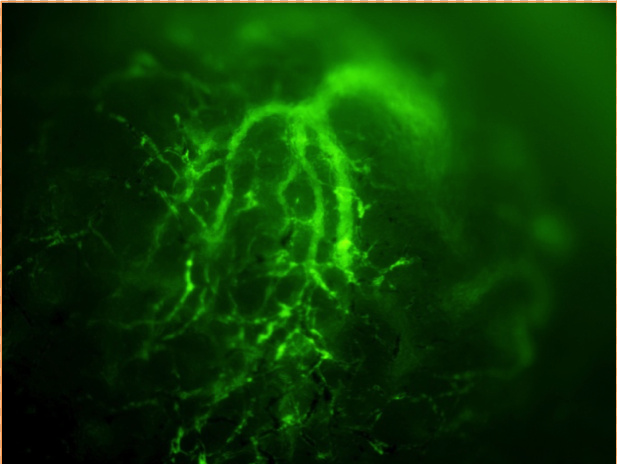
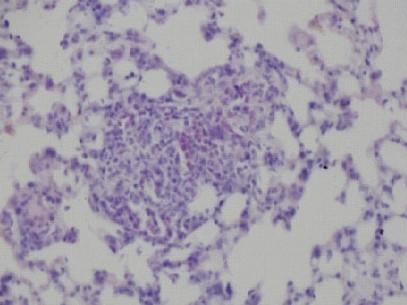
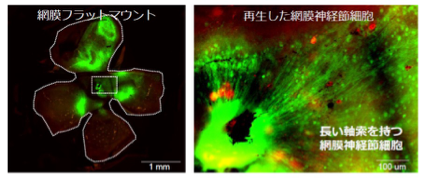
現在、日本人の死因は悪性腫瘍・虚血性心疾患・脳血管疾患が上位を占め、なかでも悪性腫瘍の割合は約3割に達し死因の1位となっています。これらの疾患に共通してみられる現象として、局所における低酸素状態を伴う点が挙げられます。生体にはこのような低酸素に応答する制御機構が備わっており、その中心的役割を担っているのが低酸素応答転写因子:HIF (hypoxia inducible factor)です。HIFは酸素が十分存在する環境下では、分解による不活化により活性が抑えられていますが、低酸素環境下では分解を免れ転写因子として機能するという特徴を有しています。この分子作用により低酸素環境下で必要とされる標的遺伝子の転写を速やかに活性化することができます。
現在までにHIF遺伝子は3種類存在することが報告されており、全身性に発現しているHIF-1α、血管内皮細胞で主に発現しているHIF-2α、抑制性に働くHIF-3αとそのバリアントであるIPAS (inhibitory PAS protein)があります。当研究室では、これらの分子機能解析はもちろんのこと遺伝子改変マウスを用いた解析によって実際に生体内で起きているHIFの作用機構解明を行っています。