|
シェーグレン症候群の病因・病態の解明と抗原特異的治療戦略の構築
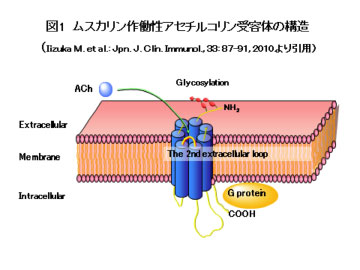
1 シェーグレン症候群(SS)患者におけるM3ムスカリン作働性アセチルコリン受容体(M3R)に対する自己免疫応答の解析 2 M3R自己免疫応答により誘導される唾液腺炎モデルマウスの構築とその病態の解析 3 M3Rのアナログペプチド(Altered peptide ligand; APL)による抗原特異的治療戦略の構築 シェーグレン症候群(Sjogren’s syndrome; SS)は唾液腺炎・涙腺炎を主体とし、様々な自己抗体の出現がみられる自己免疫疾患です。2010年厚生労働省の患者調査報告では推定患者数66,000人と報告されており患者数が比較的多い疾患です。しかし、現時点では対症療法が主であり根治的治療法の確立が最重要課題となっています。 SSの唾液腺・涙腺ではCD4陽性T細胞が多数浸潤し、腺組織の破壊および機能障害をもたらします。浸潤するT細胞が認識する自己抗原については、これまでに様々な報告がされてきました。近年、外分泌腺に高発現し、分泌に重要な役割を果たしているM3ムスカリン作働性アセチルコリン受容体(M3R)が注目されています。SS患者の末梢血中には抗M3R抗体が存在すること(Dawson L. et al. Arthritis Rheum. 2005; 52: 2984-2995)や、M3R反応性T細胞が検出されたこと(Naito Y, et al. Ann Rheum Dis. 2006; 65: 269-271)などから、SS発症においてM3R抗原への自己免疫応答の関与が示唆されています。 我々のグループでは、SS病態においてこのM3Rに対する自己免疫応答に着目し、SS患者での抗M3R抗体(M3Rに対するB細胞応答)、M3R反応性T細胞(M3Rに対するT細胞応答)の解析、さらにM3R自己免疫応答により誘導される唾液腺炎モデルマウスの構築とその病態解析、M3Rのアナログペプチド(Altered peptide ligand; APL)による抗原特異的治療戦略の構築をすすめています。 ここでは、我々のグループでの最新の研究成果と今後の展開をご紹介します。SSの患者検体を用いた研究と、マウスモデルを用いた研究を両軸とし、まさにベンチとベッドサイド双方向性のトランスレーショナルリサーチです。熱意ある若い研究者の方々を是非ともお待ちしています。 【ムスカリン作働性アセチルコリン受容体の構造と機能】 ムスカリン作働性アセチルコリン受容体は4つの細胞外領域(N末端領域、第1、第2、第3細胞外ループ)と7つの膜貫通領域を有する、Gタンパク共役型の受容体です(図1)。5つのサブタイプ(M1R−M5R)が存在し、中枢神経系、外分泌腺、平滑筋、心筋等に発現します。M3Rは外分泌腺や平滑筋に発現し、分泌や収縮に重要な役割を果たします。したがって、M3RはSSの主たる標的臓器である唾液腺・涙腺にも高発現しており、抗M3R抗体はSSにおいて病因となる自己抗体の有力な候補であると考えられます。M3Rの内因性アゴニストであるアセチルコリンが唾液腺細胞上のM3Rに結合すると、M3Rが活性化されます。アゴニストによるM3Rの活性化には、4つの細胞外領域のうち、第2細胞外ループが重要と報告されています。M3Rの活性化は、Gタンパク、ホスホリパーゼC、inositol 1, 4, 5-trisphosphate (IP3)およびIP3受容体を介して、細胞内Ca濃度上昇を引き起こします。細胞内Ca濃度上昇により、管腔側のクロールチャネルが活性化され、唾液分泌が生じます。
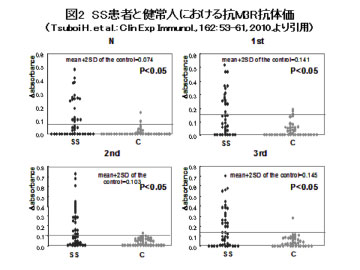
【SS患者におけるM3Rに対する自己免疫応答の解析】 抗M3R抗体 (M3Rに対するB細胞応答) 我々のグループでは、SS患者において抗M3R抗体のエピトープと機能を明らかにするため、ヒトM3Rの4つの細胞外領域の合成ペプチドを抗原としたELISAを行いました。さらにヒト唾液腺(human salivary gland; HSG)上皮細胞株における、M3Rアゴニスト(塩酸セビメリン)刺激後の細胞内Ca濃度上昇に対する抗M3R抗体の影響をCa蛍光プローブであるFluo3を用いて検討し、興味深い結果を得ました。 ELISAでは、従来報告されていた第2細胞外ループ以外の細胞外領域(N末端領域、第1、第3細胞外ループ)も抗M3R抗体のエピトープとなることが示されました。また、すべての細胞外領域に対して、抗M3R抗体の抗体価は健常人コントロールと比較して、SS患者で有意に高値でした(P<0.05、Mann?Whitney’s U-test)(図2)。 HSG細胞株を用いた抗M3R抗体の機能解析では、第2細胞外ループに対する抗M3R抗体陽性SSのIgG(N=2)は、健常人のIgG(N=1)と比較して、塩酸セビメリン刺激後の細胞内Ca濃度上昇を有意に抑制しました(P<0.05、Mann?Whitney’s U-test)。一方N末端および第1細胞外ループに対する抗M3R抗体陽性SSのIgG(それぞれN=1)はCa濃度上昇を有意に増強しました(P<0.05、Mann?Whitney’s U-test)。第3細胞外ループに対する抗M3R抗体陽性SSおよび抗M3R抗体陰性SSのIgG(それぞれN=1)はCa濃度上昇に影響しませんでした。 以上の結果から、抗M3R抗体は複数のエピトープを有し、M3Rを介する唾液分泌に影響する可能性が示唆されました。また唾液分泌への影響は、抗M3R抗体のエピトープにより異なる可能性も示されました。
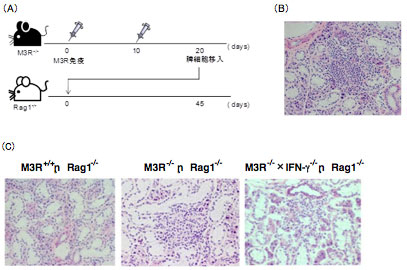
SS患者42例(一次性15例、二次性27例)、健常人42例における、M3Rペプチド特異的吸光度(Δabsorbance)を示しています。健常人における平均値+2SDを陽性と陰性のカットオフレベルとしました(グレイライン)。すべての細胞外領域に対する抗M3R抗体の抗体価および陽性率は健常人と比較して、SS患者で有意に高値でした。(P<0.05、抗体価はMann?Whitney’s U-test、陽性率はFisher’s exact probability testで検討) SS;シェーグレン症候群、C;健常人コントロール、N;N末端領域、1st;第1細胞外ループ、2nd;第2細胞外ループ、3rd;第3細胞外ループ 【M3R自己免疫応答により誘導される唾液腺炎モデルマウスの構築とその病態の解析】 M3R欠損マウスにM3Rペプチドを免疫し誘導されたM3R反応性の脾細胞を、M3Rが発現するRag1欠損マウスに移入し、病態解析を行いました(図3A)。その結果、細胞移入したRag1欠損マウスにおいて、唾液分泌量の低下、血清中の抗M3R抗体価の上昇、唾液腺への著明な細胞浸潤が認められました(図3B)。唾液腺における浸潤細胞の多くはCD4+ T細胞であり、IgGの沈着、アポトーシス細胞も検出されました。抗原提示細胞上には、MHCクラスIIやCD86分子の発現が検出され、唾液腺局所において活性化していることが明らかとなりました。IFNγおよびIL-17の発現も浸潤部位に認められ、病態の進行に関与していることが示唆されました。 また、M3R反応性T細胞のみをRag1欠損マウスに移入した場合も、同様に唾液腺炎の発症が認められました。 以上のことから、T細胞を中心としたM3Rに対する自己免疫応答が、SS類似の唾液腺炎発症に関与していることが示されました。
図3 M3R自己免疫応答により誘導される唾液腺炎モデルマウス (Iizuka M, et al. J Autoimmun. 35:383-389,2010.より引用) (A)M3R反応性脾細胞移入による唾液腺炎の誘導
(B)M3R反応性脾細胞を移入したRag1欠損マウスの唾液腺 (C)IFN-g欠損M3R反応脾細胞では唾液腺炎が減弱する 【M3Rのアナログペプチド(Altered peptide ligand; APL)による抗原特異的治療戦略の構築】 前述のモデルマウスでは、唾液分泌量の低下や抗M3R抗体価の上昇、CD4+ T細胞が主体となる唾液腺への細胞浸潤などSSと類似した唾液腺炎を発症します。そして、M3R反応性T細胞を中心とした自己免疫応答が唾液腺炎発症に重要であることを示しました。 この病態発症に重要なM3R反応性T細胞の活性を抑制することで唾液腺炎を制御することを目的として、我々はM3Rのアナログペプチド(Altered peptide ligand; APL)を使用した抗原特異的治療法の構築を目指しています(「関節リウマチ - Altered peptide ligand (APL)による関節炎制御に関する研究」の項も参照)。 実際にヒトの検討ではM3R第2細胞外ループのペプチドのAPLにおいて、in vitroでSS患者末梢血中のM3R反応性T細胞からのIFNγ産生を抑制しました。 今後は、唾液腺モデルマウスに対するAPLのin vivoでの効果を明らかにしていくと共に、SS患者において、APLによるSS患者末梢血中および唾液腺局所のM3R反応性T細胞に対する抑制効果を検証していく予定です。そして、M3RのAPLを用いた抗原特異的治療戦略を構築したいと考えています。
|
|||