|
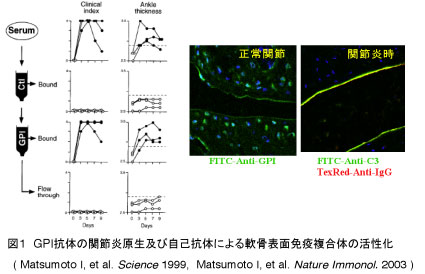
新規関節炎モデルマウスを用いた研究 関節リウマチ(RA)に対する治療戦略は、腫瘍壊死因子(TNFα)、インターロイキン-6 (IL-6)などの炎症性サイトカインの作用を抑制する分子標的治療薬の開発により大きく変遷しました。しかしながら、RA症例の約3割はTNF阻害療法に抵抗性で、新規抗リウマチ薬の開発は必至です。我々は、ヒトのRA病態により近い関節炎モデルマウスを用いて、更なる新規治療法を目指して研究を行っています。 【Glucose-6-phosphate isomerase (GPI)誘導関節炎モデルとは】 GPIはユビキタスに存在する解糖系酵素の一つであることが知られていますが、自然発症関節炎モデルであるK/BxNマウスの自己抗原として同定され、GPIの関節炎原性が示されました(図1)。
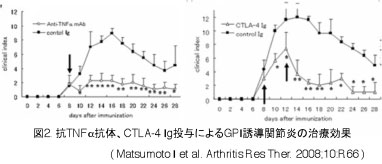
【GPI誘導関節炎モデルにおけるIL-6/IL-17の役割】 RA患者関節滑膜には、CD4陽性T細胞が多く浸潤し、一部のT細胞がクローナルに増殖することが知られています。GPI誘導関節炎の発症にもCD4陽性T細胞が必須であることは、2004年Schubertらによって明らかにされました。われわれはこのGPI誘導関節炎マウスに抗IL-17中和抗体を投与することにより関節炎を有意に抑制することができることから、関節炎の発症にはTh17細胞が寄与していることを報告しました。また、抗IL-6受容体抗体投与はTh17細胞の分化阻害、自己抗体の産生抑制、抗原特異的T細胞の増殖抑制をもたらすことにより自己免疫性関節炎が制御され、現在のIL-6抑制治療のメカニズムの一端を明らかにしました(図3)。
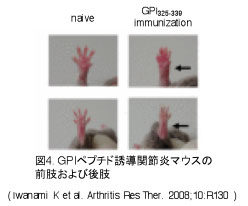
【GPIペプチド誘導関節炎モデルの確立】 GPIは558アミノ酸から構成されているタンパク質です。私たちはGPI誘導関節炎のT細胞エピトープを同定し、関節炎誘導に重要なエピトープが、GPI325-339であることを明らかにしました。GPI325-339ペプチドを免疫し、day0とday2に百日咳毒素(PT)を腹腔内投与することで、GPI誘導関節炎モデルと同様に免疫後1週間程度から早期に関節炎を惹起できます。これは世界で初めてのペプチドを用いた関節炎誘導モデルです。
上記に示したようにGPI誘導関節炎には発症時期によらずCD4陽性T細胞の役割が重要であることがすでに示されていること、GPIのT細胞ドミナントエピトープの同定から、抗原特異的CD4陽性T細胞に焦点をおいた研究も進めており、関節炎に関与していると考えられる新規病因的分子の探索とそのメカニズムについて解析を進めています。 新規関節炎抑制分子(TIARP / STEAP4)に関する研究
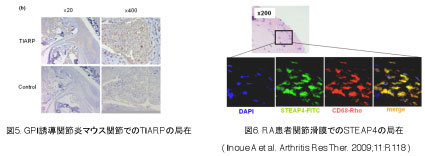
【GPI誘導関節炎モデルにおける新規病因的因子の解明】 RAにおけるTNFαの重要性は、数々の臨床データから明らかにされています。我々は、RAおよびGPI誘導関節炎で病態・病因に強く関与しているTNFαに焦点をおき、関節炎発症直後のマウス脾臓におけるTNF関連遺伝子の発現変動をGene Chipで解析しました。その結果、TNF関連分子のうち、TNFα-induced adipose-related protein (TIARP)分子が他のTNF関連因子と比べて関節炎マウス脾臓で明らかに強発現していることが分かりました。TIARPは、脂肪細胞の分化に関与する分子として初めに同定され、TNFα、IL-6やIL-1により誘導されるとの報告がなされています。TIARPのヒトorthologとしてはSTEAP4が同定されていますが、マウス、ヒトともに実際の生物学的な機能、また関節炎を含む自己免疫性疾患との関与の報告はありません。我々の解析によりTIARPは関節炎マウス脾臓および関節に局在し、特にCD11b陽性のマクロファージおよび増殖した滑膜細胞に強く発現することを見いだしました(図1A)。更に我々はヒトRA患者の滑膜組織においてもTIARPのヒトorthologであるSTEAP4発現を確認しています(図1B)。
図1. GPI誘導関節炎およびRA患者関節滑膜におけるTIARP/STEAP4の局在
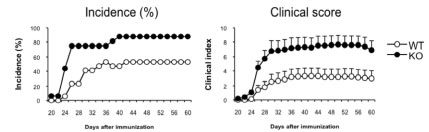
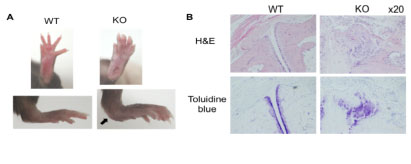
【TIARPの自己免疫性関節炎における病因的意義】 関節炎マウス脾臓および関節に強発現するTIARPの関節炎における機能を明らかにするためにわれわれは、独自にTIARP欠損マウスを作製し、関節炎におけるTIARP分子の意義をより詳細に検討しました。 TIARP欠損マウス (C57BL/6系統) にコラーゲン誘導関節炎(CIA)の誘導を試みると、TIARP欠損マウスではCIAの発症率、重症度ともに野生型マウスと比較して有意に悪化することがわかりました(図2A)。関節の組織学的スコア(炎症度、骨びらん度)も著明に高く、炎症部位には多数の好中球、MΦの浸潤が認められました(図2B)。このことからTIARPは関節炎の抑制機構に非常に重要な働きをしていることが明らかとなりました。 A.
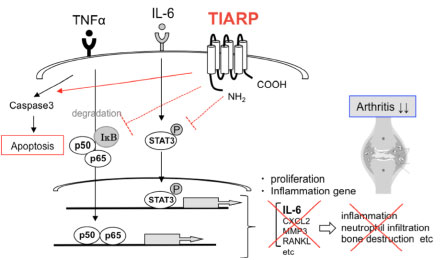
B. 図2. TIARP欠損マウスはCIA病態が増悪する 【TIARPの関節炎抑制機構の解明】 我々はTIARPの関節炎制御メカニズムをより明らかにするために、TIARP発現細胞であるマクロファージに着目して検討を行いました。TIARP欠損MΦにTNFαで刺激すると、IL-6産生量がTIARP欠損マウスで著明に増加しました。また、その下流シグナルであるNF-kBの抑制因子としてしられるIκBα発現量は、TIARP欠損マクロファージでは著明にIkBαの持続して分解されていることを明らかとしました。さらにTIARP欠損マクロファージは、TNFα誘導性アポトーシス細胞数が減少し、caspase-3蛋白の分解は野生型と比較して減弱していました。同様にIL-6シグナルに与える影響についても検討したところ、TIARP欠損マクロファージはIL-6刺激後にSTAT3のリン酸化が亢進していることがわかりました。このことから、マクロファージにおいてTIARPはアポトーシスを促進し、NF-kBおよびSTAT3シグナルを負に抑えることで炎症を制御する役割を担っていることが明らかとなりました (図3)。
図3. TIARPの関節炎制御メカニズム(シェーマ図)
驚くべきことにTIARP欠損マウスは、加齢(12ヶ月齢)により血中IL-6濃度の増加をともなって、関節炎を自然発症することが判明しました(図4)。このことは、TIARPの欠損により炎症性サイトカイン産生が増大したことにより自己免疫疾患を発症することを示唆するものと考えられます。我々の検討や、これまでの知見から、IL-6などのサイトカイン受容体シグナル異常および制御分子の機能異常により自己免疫疾患を発症することを証明したものであり、サイトカインと自己免疫疾患発症の機構を考える上で、非常に重要な知見がもたらされました。
図4. TIARP欠損マウスは関節炎を自然発症する 現在われわれは、TIARPがどのようにしてNF-κBやSTAT3などのシグナル伝達を制御しているのかについて検討を進めています。またTIARP機能を亢進さるためのリガンドの同定や抗体などを作製することで、新たなRA治療ターゲット分子の発見や病態制御に向けた新規治療法の開発が進むことを期待しています。 【関節リウマチ患者におけるSTEAP4の機能解析】 TIARPのヒトorthologは、six-transmembrane epithelial antigen of prostate 4 (STEAP4)と呼ばれています。STEAP4は、前立腺癌に高発現する蛋白として同定され、骨髄に次いで子宮や胎児肝臓に発現することが報告されています。我々の検討によりSTEAP4はRA患者PBMCおよび滑膜、特にCD68陽性滑膜細胞に強発現することを見いだしました(図5)。
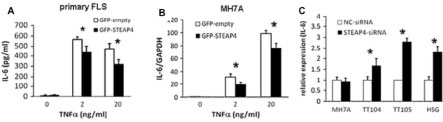
図5. STEAP4はCD68陽性RA患者滑膜細胞に発現する 滑膜細胞におけるSTEAP4の機能を明らかとするために、RA患者由来滑膜細胞へのSTEAP4遺伝子導入およびノックダウンを行いました。STEAP4過剰発現滑膜細胞は、コントロールと比較して細胞増殖が抑制され、アポトーシス細胞の有意な増加を認めました。さらに、TNFα刺激依存的なIL-6およびIL-8産生を抑制することが明らかとなりました。
図6. STEAP4は、IL-6産生を抑制する この分子のヒトにおける意義については未だ不明な点も数多く、RA患者滑膜細胞のほか健常人末梢血の好中球ならびに単球にも発現が認められることから、各々の細胞におけるSTEAP4分子の機能解析などを中心に、現在検討を進めています。
|
|