*****拀攇戝妛戝妛堾丂堛妛堛椕宯丂惗棟壔妛尋媶幒 *****
Recent research
***** 嬥曐尋媶幒偺嵟嬤偺尋媶惉壥 *****
Home > Recent research
***** Recent research *****
PIP5K

乽NMDA庴梕懱傪夘偟偨PIP5K偺妶惈壔偼丄PI(4,5)P2 偺嶻惗傪堷偒婲偙偟丄挿婜梷埑偵偍偗傞AMPA庴梕懱偺僄儞僪僒僀僩乕僔僗偵昁恵偺栶妱傪壥偨偡乿
[奣梫]
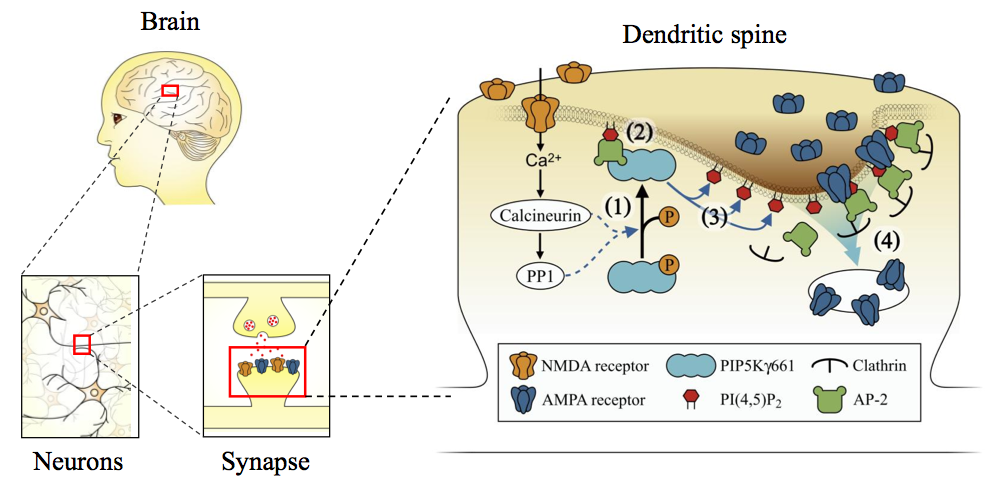 擼偺婰壇丒妛廗婡擻偼恄宱嵶朎娫偺僔僫僾僗揱払岠棪偺摦揑側曄壔丄偡側傢偪僔僫僾僗壜慪惈偵傛傝巟偊傜傟偰偄傞偲峫偊傜傟偰
偍傝丄僔僫僾僗揱払岠棪
傪帩懕揑偵掅壓偝偣傞僔僫僾僗壜慪惈偲偟偰挿婜梷埑偑偁傝傑偡丅挿婜梷埑偺敪尰偵偼丄嫽暠惈僔僫僾僗揱払傪庡偲偟偰扴偆AMPA庴梕懱偑僔僫僾僗屻枌偐傜
嵶朎撪偵庢傝崬傑傟傞偙偲偑昁恵偱偁傞偲抦傜傟偰偄傞傕偺偺丄恄宱妶摦偺曄壔偑偳偺傛偆偵偟偰偙偺庢傝崬傒婡峔傪惂屼偡傞偺偐偼晄柧偱偟偨丅杮榑暥偱偼偙
偺庢傝崬傒婡峔偺惂屼場巕偲偟偰儕儞帀幙戙幱峺慺PIP5K兞661偵拝栚偟丄NMDA庴梕懱偺妶惈壔偑PIP5K兞661偺峺慺妶惈傪忋徃偝偣傞偙偲丄
偙傟偵傛傝嶻惗偝傟傞儕儞帀幙PI(4,5)P2偑AMPA庴梕懱偺庢傝崬傒婡峔傕偨傜偡堷偒嬥偵側傞偙偲傪尒偄偩偟傑偟偨丅
偙偺敪尒偼僔僫僾僗壜慪惈偺儊僇僯僘儉傪暘巕儗儀儖偱愢柧偡傞怴偨側抦尒偲偟偰丄擼偺婰壇丒妛廗婡擻傪巟偊傞婎杮尨棟偺棟夝偵峷專偡傞偙偲偑婜懸偝傟傑
偡丅
擼偺婰壇丒妛廗婡擻偼恄宱嵶朎娫偺僔僫僾僗揱払岠棪偺摦揑側曄壔丄偡側傢偪僔僫僾僗壜慪惈偵傛傝巟偊傜傟偰偄傞偲峫偊傜傟偰
偍傝丄僔僫僾僗揱払岠棪
傪帩懕揑偵掅壓偝偣傞僔僫僾僗壜慪惈偲偟偰挿婜梷埑偑偁傝傑偡丅挿婜梷埑偺敪尰偵偼丄嫽暠惈僔僫僾僗揱払傪庡偲偟偰扴偆AMPA庴梕懱偑僔僫僾僗屻枌偐傜
嵶朎撪偵庢傝崬傑傟傞偙偲偑昁恵偱偁傞偲抦傜傟偰偄傞傕偺偺丄恄宱妶摦偺曄壔偑偳偺傛偆偵偟偰偙偺庢傝崬傒婡峔傪惂屼偡傞偺偐偼晄柧偱偟偨丅杮榑暥偱偼偙
偺庢傝崬傒婡峔偺惂屼場巕偲偟偰儕儞帀幙戙幱峺慺PIP5K兞661偵拝栚偟丄NMDA庴梕懱偺妶惈壔偑PIP5K兞661偺峺慺妶惈傪忋徃偝偣傞偙偲丄
偙傟偵傛傝嶻惗偝傟傞儕儞帀幙PI(4,5)P2偑AMPA庴梕懱偺庢傝崬傒婡峔傕偨傜偡堷偒嬥偵側傞偙偲傪尒偄偩偟傑偟偨丅
偙偺敪尒偼僔僫僾僗壜慪惈偺儊僇僯僘儉傪暘巕儗儀儖偱愢柧偡傞怴偨側抦尒偲偟偰丄擼偺婰壇丒妛廗婡擻傪巟偊傞婎杮尨棟偺棟夝偵峷專偡傞偙偲偑婜懸偝傟傑
偡丅
(Takamitsu Unoki et al., NMDA Receptor-Mediated PIP5K Activation to Produce PI(4,5)P2 Is Essential for AMPA Receptor Endocytosis during LTD, Neuron. 73, 135-148, 2012)
仸杮尋媶偼宑滀媊弇戝妛堛妛晹 惗棟妛嫵幒 桵尋媶幒偲偺嫟摨尋媶偵傛傞傕偺偱偡丅
仸杮尋媶惉壥偼 宑滀媊弇戝妛堛妛晹 拀攇戝妛堛妛堛椕宯僾儗僗儕儕乕僗偲偟偰傕曬摴偝傟偰偄傑偡丅徻偟偔偼偙偪傜
PLD

乽p38MAPK-PLD2僔僌僫儖偵傛傞恄宱撍婲宍惉惂屼乿
[奣梫]
帀幙惈僔僌僫儖揱払偵偍偄偰偼丄嵶朎枌峔惉惉暘偱偁傞儕儞帀幙偲偦偺戙幱嶻暔偑帀幙惈僔僌僫儖暘巕偲偟偰摥偒壓棳傊僔僌僫儖傪揱偊傞偙偲偱條 乆側嵶朎婡擻傪挷愡偟偰偄傑偡丅 儂僗僼僅儕僷乕僛D (PLD) 偼惗懱枌峔惉儕儞帀幙偺儂僗僼傽僠僕儖僐儕儞(PC)傪壛悈暘夝偟偰丄儂僗僼傽僠僕儞巁(PA)傪嶻惗偡傞儕儞帀幙戙幱峺慺偱偁傝丄PLD偵傛傝嶻惗偝傟 傞PA偼乽帀幙惈僔僌僫儖揱払暘巕乿偲偟偰摥偔偨傔丄PLD偼PA傪夘偟偰條乆側嵶朎婡擻傪挷愡偟偰偄傞偲峫偊傜傟偰偄傑偡丅尰嵼傑偱偵丄傎擕椶PLD偲 偟偰PLD1偲PLD2偺俀庬椶偺PLD傾僀僜僓僀儉偑摨掕偝傟偰偍傝丄尰嵼傑偱偵PLD偺惗棟婡擻偵偮偄偰偼惛椡揑側夝愅偑側偝傟丄PLD1
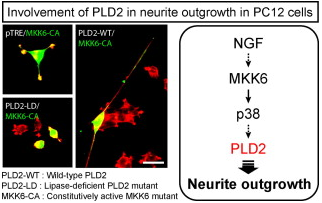 偑嵶朎撪彫朎桝憲傗暘斿斀墳偵丄PLD2偼僄儞僪
僒僀僩乕僔僗側偳偺嵶朎枌僟僀僫儈僋僗偵娭梌偡傞偙偲偑帵嵈偝傟偰偄傑偡丅
杮榑暥偱偼PLD傾僀僜僓僀儉偺偆偪偺PLD2偑p38MAP僉僫乕僛偵傛傞恄宱撍婲怢挿僔僌僫儖傪拠夘偡傞偙偲傪徹柧偟傑偟偨丅恄宱儌僨儖嵶朎偲偟斈梡
偝傟偰偄傞PC12嵶朎傪恄宱憹怋場巕乮NGF乯偵傛傝巋寖偟偨偲偙傠丄PLD2偺妶惈壔偑娤嶡偝傟丄恄宱撍婲怢挿偑婲偙傞偙偲丄傑偨條乆側慾奞嵻丄曄堎
懱傪梡偄偨幚尡偐傜丄p38偺壓棳偱PLD2偑婡擻偟丄恄宱撍婲怢挿傪惂屼偡傞偙偲傪徹柧偟傑偟偨丅崱夞敪尒偟偨怴偨側PLD偺僔僌僫儖宱楬偐傜丄崱屻峏
側傞PLD傪夘偟偨帀幙惈僔僌僫儖揱払傗嵶朎婡擻偺夝柧偑婜懸偝傟傑偡丅
偑嵶朎撪彫朎桝憲傗暘斿斀墳偵丄PLD2偼僄儞僪
僒僀僩乕僔僗側偳偺嵶朎枌僟僀僫儈僋僗偵娭梌偡傞偙偲偑帵嵈偝傟偰偄傑偡丅
杮榑暥偱偼PLD傾僀僜僓僀儉偺偆偪偺PLD2偑p38MAP僉僫乕僛偵傛傞恄宱撍婲怢挿僔僌僫儖傪拠夘偡傞偙偲傪徹柧偟傑偟偨丅恄宱儌僨儖嵶朎偲偟斈梡
偝傟偰偄傞PC12嵶朎傪恄宱憹怋場巕乮NGF乯偵傛傝巋寖偟偨偲偙傠丄PLD2偺妶惈壔偑娤嶡偝傟丄恄宱撍婲怢挿偑婲偙傞偙偲丄傑偨條乆側慾奞嵻丄曄堎
懱傪梡偄偨幚尡偐傜丄p38偺壓棳偱PLD2偑婡擻偟丄恄宱撍婲怢挿傪惂屼偡傞偙偲傪徹柧偟傑偟偨丅崱夞敪尒偟偨怴偨側PLD偺僔僌僫儖宱楬偐傜丄崱屻峏
側傞PLD傪夘偟偨帀幙惈僔僌僫儖揱払傗嵶朎婡擻偺夝柧偑婜懸偝傟傑偡丅(Watanabe H & Hongu T et. al., Phospholipase D2 activation by p38 MAP kinase is involved in neurite outgrowth. Biochem Biophys Res Commun. 413(2):288-93, 2011)
Arf6

乽儅僂僗屄懱偵偍偗傞Arf6偺帪嬻娫揑側敪尰暘晍夝愅乿
[奣梫]
惗懱偵偍偄偰憻婍偼條乆側嵶朎偵傛傝宍惉偝傟偰偍傝丄偦傟傜偺嵶朎偑堦偮偺憻 婍撪偱堎側傞栶妱傪摥偄偰偄傞丅偝傜偵丄偦傟傜嵶朎偼丄憻婍偺敪惗偵敽偄僟僀 僫儈僢僋偵曄壔偡傞丅偦偺偨傔,惗懱偱偺堚揱巕丄僞儞僷僋幙偺徻嵶側敪尰暘晍 偼惗懱偱偺尋媶偵偍偄偰旕忢偵桳塿側忣曬偱偁傝丄惗棟婡擻夝愅傪峴偆偵偁偨傝 昁梫側傕偺偱偁傞丅掅暘巕検G僞儞僷僋幙偱偁傞ADP-r
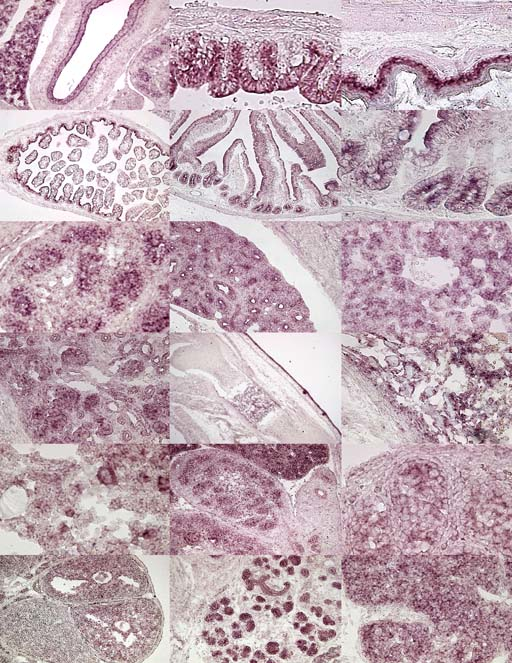 ibosylation
factor 6 (
Arf6) 偼庬乆偺嵶朎偵偍偄偰丄傾僋僠儞崪奿偺嵞峔惉丄嵶朎愙拝偺惂屼丄僄儞僪
僒僀僩乕僔僗丄僄僉僜僒僀僩乕僔僗傗嵶朎撪彫朎桝憲側偳偺懡偔偺廳梫側嵶朎婡
擻偵娭梌偟偰偄傞丅偟偐偟丄偙傟傜偺抦尒偼攟梴嵶朎宯傪梡偄偨in vitro偱偺尋
媶偵傛傞傕偺偱偁傝丄惗懱儗儀儖偱偺Arf6偺婡擻夝愅偼傎偲傫偳峴傢傟偰偍傜偢丄
惗懱偱偺惗棟婡擻夝愅偑媫柋偲偝傟偰偄傞丅偟偐偟丄偙傟傑偱Arf6偺奺憻婍慻怐
偱偺帪娫揑•嬻娫揑側敪尰暘晍偼晄柧側傑傑偱偁傝丄偙偺偙偲偑惗懱偱偺惗棟婡擻
夝愅偺恑峴傪朩偘傞棟桼偺傂偲偮偲側偭偰偄傞丅偦偙偱杮榑暥偱偼丄偙偺栤戣傪
夝寛偟Arf6偺惗棟婡擻夝愅偺尋媶傪懀恑偝偣傞偨傔丄歁擕摦暔儌僨儖偲偟偰儅僂
僗傪梡偄丄帪娫揑乮僗僥乕僕摿堎揑乯丒嬻娫揑乮嵶朎摿堎揑乯側Arf6 mRNA偺敪
尰僷僞乕儞傪in situ 僴僀僽儕僟僀僛乕僔儑儞朄傪梡偄偰夝愅偟偨丅偦偺寢壥丄
Arf6偼敪惗抜奒偵偍偄偰丄憻婍偛偲偵堎側偭偨僞僀儈儞僌偱敪尰偟偰偄傞偙偲偑
敾柧偟偨丅偙傟傜偺抦尒偼Arf6偑條乆側憻婍偱堎側傞廳梫側栶妱傪扴偭偰偄傞壜
擻惈傪帵嵈偡傞傕偺偱偁傝丄崱屻偺Arf6偺惗懱偱偺惗棟婡擻夝愅偺尋媶偵偍偄偰
桳塿側忣曬偵側傞偲峫偊傜傟傞丅
ibosylation
factor 6 (
Arf6) 偼庬乆偺嵶朎偵偍偄偰丄傾僋僠儞崪奿偺嵞峔惉丄嵶朎愙拝偺惂屼丄僄儞僪
僒僀僩乕僔僗丄僄僉僜僒僀僩乕僔僗傗嵶朎撪彫朎桝憲側偳偺懡偔偺廳梫側嵶朎婡
擻偵娭梌偟偰偄傞丅偟偐偟丄偙傟傜偺抦尒偼攟梴嵶朎宯傪梡偄偨in vitro偱偺尋
媶偵傛傞傕偺偱偁傝丄惗懱儗儀儖偱偺Arf6偺婡擻夝愅偼傎偲傫偳峴傢傟偰偍傜偢丄
惗懱偱偺惗棟婡擻夝愅偑媫柋偲偝傟偰偄傞丅偟偐偟丄偙傟傑偱Arf6偺奺憻婍慻怐
偱偺帪娫揑•嬻娫揑側敪尰暘晍偼晄柧側傑傑偱偁傝丄偙偺偙偲偑惗懱偱偺惗棟婡擻
夝愅偺恑峴傪朩偘傞棟桼偺傂偲偮偲側偭偰偄傞丅偦偙偱杮榑暥偱偼丄偙偺栤戣傪
夝寛偟Arf6偺惗棟婡擻夝愅偺尋媶傪懀恑偝偣傞偨傔丄歁擕摦暔儌僨儖偲偟偰儅僂
僗傪梡偄丄帪娫揑乮僗僥乕僕摿堎揑乯丒嬻娫揑乮嵶朎摿堎揑乯側Arf6 mRNA偺敪
尰僷僞乕儞傪in situ 僴僀僽儕僟僀僛乕僔儑儞朄傪梡偄偰夝愅偟偨丅偦偺寢壥丄
Arf6偼敪惗抜奒偵偍偄偰丄憻婍偛偲偵堎側偭偨僞僀儈儞僌偱敪尰偟偰偄傞偙偲偑
敾柧偟偨丅偙傟傜偺抦尒偼Arf6偑條乆側憻婍偱堎側傞廳梫側栶妱傪扴偭偰偄傞壜
擻惈傪帵嵈偡傞傕偺偱偁傝丄崱屻偺Arf6偺惗懱偱偺惗棟婡擻夝愅偺尋媶偵偍偄偰
桳塿側忣曬偵側傞偲峫偊傜傟傞丅(Akiyama M et. al., Tissue- and development-dependent expression of the small GTPase Arf6 in mice. Dev Dyn. 239(12):3416-35, 2010 )