西村隆史、貝淵弘三(名古屋大学・大学院医学系研究科・細胞情報薬理学講座)
神経細胞は1本の軸索と複数の樹状突起という形態的にも機能的にも異なる突起を有している。樹状突起は他の神経細胞からの情報を受け取り、軸索は情報を他の細胞に伝える。発生過程において、神経細胞は樹状突起から軸索へのシグナルの流れを保証する極性を確立する。軸索と樹状突起は共に未分化な神経突起から分化するが、神経細胞の極性はまず未分化な神経突起のうちの1本(将来の軸索)が急速に伸長する現象として形態的に特徴づけられる。また、神経細胞の極性は形態上のみならず、蛋白質構成においても見られる(図1)1)。最近、神経細胞の極性形成、つまり軸索と樹状突起の形成には細胞膜輸送や細胞骨格の再構築、さらにそれらを制御するシグナル伝達系が重要であることがわかってきた2),
3)。どのような分子メカニズムによって軸索もしくは樹状突起への運命決定がなされるのか。また、どうして複数ある突起のうち一本のみが軸索となるのか。
 |
図1. 神経細胞の極性
A:培養海馬神経細胞の極性形成過程。神経細胞は1本の軸索と複数の樹状突起を形成するが、共に未成熟な神経突起から分化する。伸長しつつある軸索の先端には比較的大きな成長円錐が形成される。文献1より改変。
B:軸索が分化した神経細胞における蛋白質の局在の違い。緑色:CRMP-2の局在、青色:細胞表面に発現しているL1の局在(軸索)、赤色:細胞内に取り込まれたTransferrinの局在(未成熟な神経突起と細胞体)。文献7より改変。 |
筆者らの研究室では、脳内におけるRhoキナーゼの新規基質蛋白質を探索し、CRMP-2を見出した4)。筆者らはCRMP-2が神経細胞の極性形成・軸索伸長に重要な役割を果たすことを明らかにしてきた。初代培養海馬神経細胞において、CRMP-2は伸長しつつある軸索の遠位部に濃縮し、野生型のCRMP-2を過剰発現させると軸索伸長が促進され、軸索様突起が複数本形成される5)。また、CRMP-2のC末欠損変異体を発現させると、軸索伸長が阻害され軸索形成が抑制される(先端脳ニュースレター第2巻第2号参照)。筆者らはCRMP-2の軸索形成における作用機構を明らかにするために、CRMP-2結合蛋白質の探索を行った。野生型CRMP-2を用いたアフィニティーカラムにより、CRMP-2結合蛋白質として微小管の構成分子であるα-およびβ-tubulinを同定した6)。CRMP-2は通常テトラマー(四量体)として存在するが、tubulin存在下ではモノマーとしてα/β-tubulinヘテロダイマーに直接結合し、微小管の重合を促進することがわかった。また、CRMP-2のtubulin結合領域を欠損した変異体は、軸索形成および軸索伸長活性を示さなかった。よって、微小管重合活性がCRMP-2の軸索形成・軸索伸長に必要であることが明らかとなった。CRMP-2は軸索の遠位部において、微小管の重合を促進することで軸索伸長を制御していると考えられる(図2)。
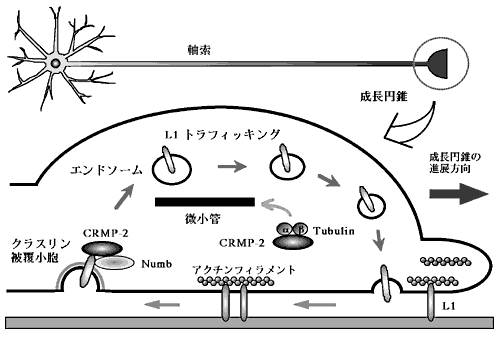 |
図2. CRMP-2による軸索伸長制御機構
軸索先端に形成される成長円錐の側方断面図を模式化した。CRMP-2はtubulinヘテロ2量体と結合し、微小管の重合を促進する。一方、CRMP-2はNumbと結合し、神経細胞接着分子L1のエンドサイトーシスを制御する。細胞内に取り込まれたL1は微小管依存的に運ばれリサイクリングされることで、神経突起は効率よく伸長できると考えられる。 |
また、筆者らはCRMP-2のC末欠損変異体を用いた酵母two-hybridスクリーニングにより、CRMP-2の結合蛋白質としてNumbを同定した7)。NumbはAP-2複合体と結合し、クラスリン依存的エンドサイトーシスに関与することが知られている8)。初代培養海馬神経細胞において、Numbは神経突起先端部に強い濃縮を示し、軸索先端部に形成される成長円錐の中央部においてCRMP-2と共局在を示した。野生型Numbを海馬神経細胞に発現させると軸索伸長が促進された。Numbと結合するCRMP-2のC末欠損変異体は軸索伸長を阻害し、Numbと結合しない欠損変異体では効果が認められなかった。CRMP-2とNumbは、軸索先端の成長円錐において何らかの分子のエンドサイトーシスに関与することで軸索伸長を制御していると考えられた。そこで、筆者らは神経細胞接着分子L1に着目した。L1はIgGスーパーファミリーに属する一回膜貫通型接着分子で、神経細胞の移動や神経突起伸長に関与する。L1は細胞内ドメインを介してAP-2複合体と結合し、成長円錐の中央部においてエンドサイトーシスされる9)。細胞内に取り込まれたL1は微小管依存的に運ばれ、成長円錐の先導端において分泌される10)。成長円錐内での局所的なL1のリサイクリングは神経突起伸長に関与する事が知られている11)。まず、L1がNumbによるエンドサイトーシスの標的分子となるかどうか検討した。L1はNumbと成長円錐の中央部において共局在を示し、さらにL1とNumbの共沈降が確認された。次に、軸索先端でおこるL1エンドサイトーシスに及ぼすCRMP-2変異体の影響を検討した。Numbと結合し軸索伸長を阻害するCRMP-2欠損変異体を発現させると、成長円錐でのL1エンドサイトーシスが阻害された。さらにsiRNAを用いたRNA干渉法によりCRMP-2の発現を抑制すると、軸索伸長およびL1エンドサイトーシスが抑制された。以上の結果より、CRMP-2はNumbと結合し軸索先端でのL1エンドサイトーシスおよびリサイクリングに関与していることが明らかとなった(図2)。
方向性を持って運動する繊維芽細胞などの先導端と同様に、神経突起先端の成長円錐ではエンドサイトーシスとエクソサイトーシスが高頻度に起こっている。神経突起伸長における細胞膜・接着分子の主要な供給源はトランスゴルジネットワーク由来の分泌小胞にあると考えられるが12)、成長円錐で一旦細胞表面に出現した接着分子は神経突起の伸長と共に細胞体側に相対的に移動することになる。成長円錐内で局所的に接着分子の取り込みとリサイクリングを行うことにより、神経突起は効率よく伸長することが出来ると考えられる。また、細胞内に取り込まれた小胞の輸送は微小管依存的であるため、CRMP-2による微小管の重合促進は単に軸索伸長の際の骨格となるだけでなく、より先端部への小胞の輸送にも働くと考えられる。よって、CRMP-2は細胞骨格と膜輸送の両方に関与することで、協調的に軸索形成や軸索伸長を制御していると考えられる。以上の結果は神経細胞の極性形成機構の解明に向けての研究に大きく貢献するものと考えられる。
文献
1) Dotti CG, et al: J Neurosci (1988) 8: 1454-1468
2) Craig AM, et al: Annu Rev Neurosci (1994) 17: 267-310
3) Fukata Y, et al: Neurosci Res (2002) 43: 305-315
4) Arimura N, et al: J Biol Chem (2000) 275: 23973-23980
5) Inagaki N, et al: Nat Neurosci (2001) 4: 781-782
6) Fukata Y, et al: Nat Cell Biol (2002) 4: 583-591
7) Nishimura T, et al: Nat Cell Biol (2003) 5: 819-826
8) Santolini E, et al: J Cell Biol (2000) 151: 1345-1352
9) Kamiguchi H, et al: J Neurosci (1998) 18: 5311-5321
10) Kamiguchi H, et al: J Neurosci (2000) 20: 3676-3686
11) Kamiguchi H, et al: J Neurosci (2001) 21: 9194-9203
12) Jareb M, et al: J Neurosci (1997) 17: 8955-8963
|

