古川貴久(大阪バイオサイエンス研究所・発生生物学部門)
網膜視細胞は錐体・桿体の2種類の細胞からなり、眼球の後方に位置し、哺乳類において唯一の光センサーとして働く。網膜色素変性症や近年先進国で著しい増加を示している老人性黄斑変性症、糖尿病性網膜症等の疾患で網膜視細胞が傷害されると、著しい視力障害を来す。これらの疾患に対しては、その進行を遅らせる以外に根本的な治療法がないのが現状である。網膜視細胞は、その解剖学的および臨床的重要性から多くの研究がなされてきたが、発生メカニズムについてはまだ十分に解明されていなかった。また、松果体については、体内リズムとの関連について多くの研究がなされてきたが、その発生メカニズムは不明であった。
我々は以前より網膜視細胞の発生機構を明らかにすべく研究してきた。以前の研究において、我々は網膜視細胞と松果体に特異的に発現する転写因子Crx
を単離し1)、いくつかの網膜変性疾患の原因遺伝子であることを明らかにした2)。その後、ノックアウトマウスの解析により、Crx
が視細胞における光受容反応および松果体におけるメラトニン合成に重要であることを示した3)。しかしながら、Crx
のホモ接合ノックアウトマウスにおいても視細胞の初期発生がみられることから、網膜視細胞発生の「最初の鍵」を握る遺伝子が何であるかは、Crx
遺伝子の発見に関わらず不明であった。我々は、Crx のノックアウトマウスの解析から、Crx と機能的に重複する遺伝子の存在を示唆していた3)。そこで今回、Crx
と同じOtx ファミリーに属し、網膜における発現が報告されているOtx2に注目した。Otx2 はショウジョウバエの遺伝子orthodenticle
の哺乳類におけるホモログとしてクローニングされ4)、前脳、中脳、松果体、神経網膜、網膜色素上皮といった組織における発現が報告されている。我々は今回の研究において、視細胞が網膜幹細胞から分化する際の最初の鍵を握る遺伝子がOtx2
であることを明らかにした5)。
まず、in situ hybridizationによりOtx2 の時間的、空間的発現パターンをCrx
と比較した。Otx2 の神経網膜における発現はCrx よりもやや先行して発生過程の視細胞にみられ、胎生期網膜ではCrx
の発現パターンに類似していたが、生後網膜では視細胞での発現がほとんどみられなくなった。次に、Otx2 の網膜視細胞発生における役割を調べるために、コンディショナルノックアウトマウスを解析した。Otx2
のホモ接合ノックアウトマウスは胎生致死であるので、Crx プロモーター6)の制御下に網膜視細胞および松果体において特異的にOtx2
の発現が消失するようなコンディショナルノックアウトマウスを作成した。Otx2 コンディショナルノックアウトマウスでは、網膜視細胞の発生はみられず、網膜神経細胞の一種であるアマクリン細胞が著明に増加していた(図1)。
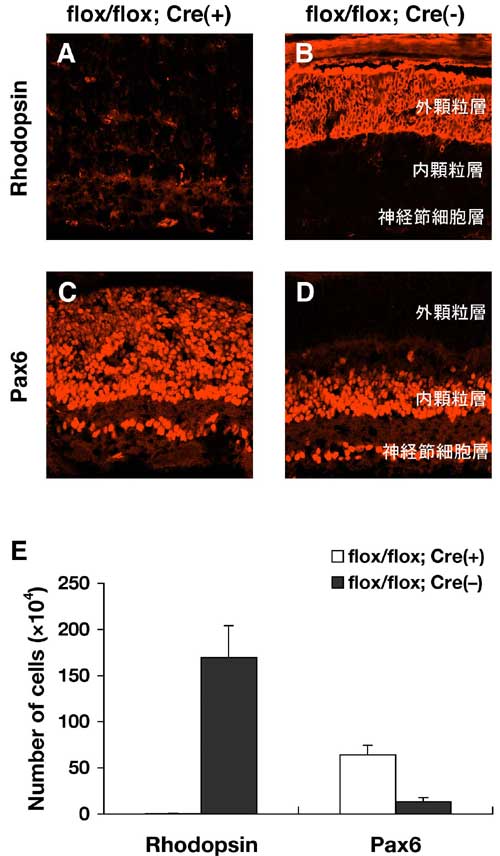 |
図1. Otx2 コンディショナルノックアウトマウスの網膜免疫染色像
A-D: Otx2 コンディショナルノックアウトマウス(A, C)では、コントロールマウス(B, D)と比較してロドプシン陽性細胞(視細胞)がほとんどみられず、Pax6陽性細胞(アマクリン細胞)が著明に増加している。
E: トリプシンで網膜細胞を分散し、免疫染色にて細胞数を定量した。Otx2 コンディショナルノックアウトマウスでは、ロドプシン陽性細胞が消失したために見かけ上Pax6陽性細胞が増加しているのではなく、実際の細胞数も増加している。これは、細胞運命の転換を意味する。 |
これは、本来であれば網膜視細胞に分化すべき細胞が、Otx2 の機能消失により、アマクリン細胞へと細胞運命を転換したことによると考えられる。また、松果体は完全に欠損していた。Otx2
コンディショナルノックアウトマウスの網膜における各種転写因子の発現を調べたところ、Crx の発現が著しく低下していた。また、レトロウィルスベクターを用いてラットの網膜未分化前駆細胞にOtx2
遺伝子を強制発現させると、アマクリン細胞、双極細胞、ミューラー細胞への分化が抑制され、視細胞への分化が促進されることが明らかになった。さらに、Crx
のプロモーター領域を用いてルシフェラーゼアッセイを行い、Otx2 がCrx プロモーター上のOTX結合部位を介してCrx
の発現を制御することを示唆するデータが得られた。これらの結果から、Otx2 は網膜視細胞の運命決定に必要かつ十分であり、またCrx
の上流遺伝子として働くことが示された(図2)。
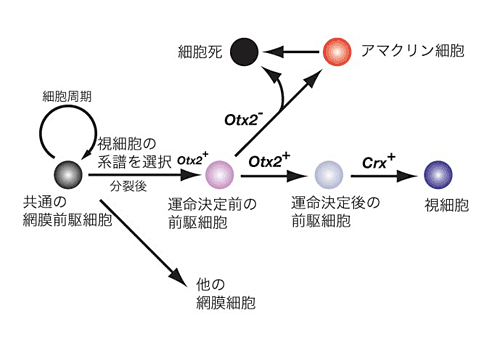 |
図2. 網膜視細胞運命決定のモデル
網膜共通の前駆細胞のうち、細胞分裂を終了し、視細胞の系譜を選択したもの はOtx2を発現する。Otx2はCrxの発現を誘導し、視細胞へと分化する。遺伝子操作により、細胞運命決定前の前駆細胞からOtx2の発現を消失させると、視細胞の前駆細胞は細細胞運命をアマクリン細胞に変更し、一部は細胞死に至る。 |
今回の研究で、Otx2 が網膜視細胞および松果体の初期発生を制御する最上流に位置する遺伝子であることが明らかになった。網膜視細胞の運命を決定する因子が何かということが、この分野での大きな疑問の一つであったが、その因子がOtx2
であると解明された。ただし、視細胞の運命決定機構を完全に理解するためには、まだいくつか重要な疑問がある。まず、Otx2
の網膜視細胞での発現の誘導機構である。Otx2 遺伝子は網膜幹細胞には発現しておらず、網膜幹細胞が網膜視細胞に分化し始める時に発現する。Otx2の発現がどのように誘導されるのかが次の重要な問題である。次いで、Otx2
遺伝子の機能の特異性の問題である。Otx2 は脳にも発現しているにもかかわらず、脳のニューロンはCrx
を発現せず、網膜視細胞にも分化しない。網膜色素細胞にも、高いレベルでOtx2 が発現しているが、Crx を発現せず、網膜視細胞とは異なる細胞である。我々は、Otx2
が発現していても、網膜以外では抑制因子の存在によってCrx が発現せず、網膜視細胞に分化しないと考えている。こういった謎を明らかにできれば、最終的に網膜視細胞の運命決定を分子のレベルで理解できると考えられる。そして、これは脊椎動物の中枢神経系の様々なニューロンの運命決定の理解にも大きく寄与すると期待される。
文献
1) Furukawa, T., Morrow, E.M. and Cepko, C.L.
Crx, a novel otx-like homeobox gene, shows photoreceptor-specific expression
and regulates photoreceptor differentiation. Cell (1997) 91: 531-541
2) *Freund, C.L., *Gregory-Evans, C.Y., *Furukawa, T., Papaioannou,
M.,, Looser, J., Ploder, L., Bellingham, D.Ng., Herbrick, J.-A. S.,
Duncan, A., Scherer, S.W., Tsui, L.-C., Loutradis-Anagnstou, A., Jacobson,
S.G., Cepko, C.L., Bhattacharya, S.S.
Cone-rod dystrophy due to mutations in a novel photoreceptor-specific
homeobox gene(CRX) essential for maintenance of the photoreceptor. Cell
(1997) 91: 543-553
(*First three authors equally contributed to this work.)
3) *Furukawa, T., Morrow, E.M., Li, T., Davis, F.C., and *Cepko, C.L.
Retinopathy and attenuated circadian entrainment in Crx-deficient mice.
Nat Genet (1999) 23: 466-470
(*Corresponding author)
4) Simeone, A., Acampora, D., Gulisano, M., Stornaiuolo, A., Boncinelli,
E.
Nested expression domains of four homeobox genes in developing rostral
brain. Nature (1992) 358: 687-690
5) Nishida, A., Furukawa, A., Koike, C., Tano, Y., Aizawa, S., Matsuo,
I., Furukawa, T.
Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal
gland devlopment. Nat Neurosci (2003) 6: 1255-1263
6) Furukawa, A., Koike, C., Lippincott, P., Cepko, C.L., and Furukawa,
T.
The mouse Crx 5’ upstream transgene sequence directs a cell-specific
and developmentally regulated expression in retinal photoreceptor cells.
J Neurosci (2002) 22: 1640-1647
|


