研究内容
私たちは、神経回路を作り出す分子メカニズムを明らかにする事を目的として研究を行っています。 脳機能は、胎児期につくられる神経回路の上に成り立っていますが、どの様にして神経回路網が形成されるかについては未だ良く分かっていません。我々は、神経細胞の分化、神経軸索のガイダンス、特異的なシナプス形成から神経機能獲得に至るプロセスに焦点を絞り、これらの過程を制御する分子・遺伝子の機能解析を進めています。分子生物学を基本としながら、マウスやゼブラフィッシュの発生工学的手法を用いて、神経系の成り立ちと働きを支える分子の機能を明らかにしようとしています。
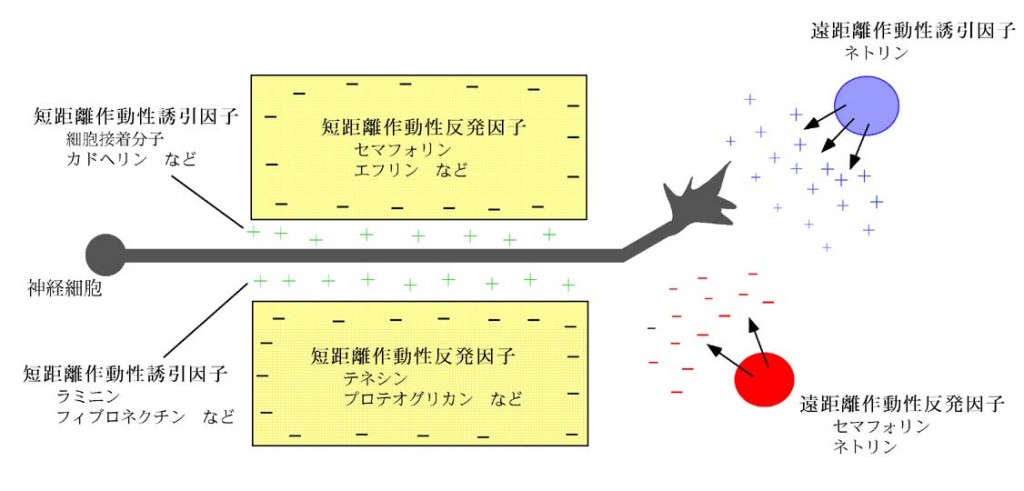
ネトリン受容体の同定
ネトリンは、脊髄のフロアープレートから分泌され、脊髄交連神経細胞の軸索を誘引する活性を持つ分子として同定された分泌蛋白であり、神経回路形成を司る軸索ガイダンス分子の代表です。線虫やショウジョウバエの神経回路形成においても重要な役割を担っています。我々は、カリフォルニア大学サンフランシスコ校のMarc Tessier-Lagine研究室でネトリン受容体の研究を行い、DCC (Deleted in Colorectal Cancer) や線虫のUNC-5遺伝子の脊椎動物相同遺伝子が、ネトリン受容体である事を明らかにしました。
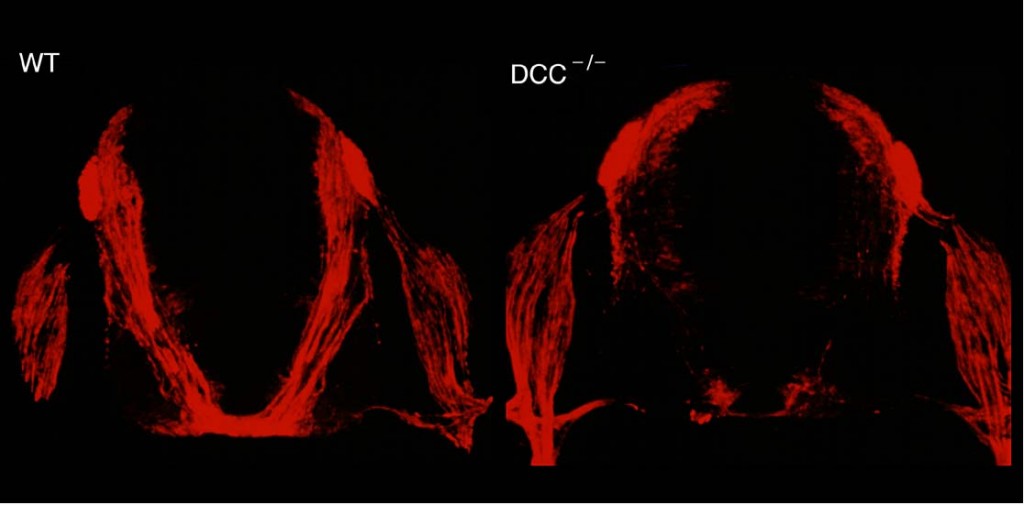
ネトリン受容体であるDCC遺伝子を破壊したマウスでは、正常のマウス(左)に比べて、脊髄交連神経線維の走行が異常になる(右)。
参考文献:
- Keino-Masu K et al. (1996) Cell 87: 175-185.
- Leonardo Edet al. (1997) Nature 386: 833-838.
- Fazeli A et al. (1997) Nature 386: 796-804.
- 桝正幸. (1996) 細胞工学 15: 172-180.
- 桝正幸, 桝和子. (1999) 細胞工学 18: 39-47.
新規のスルファターゼ遺伝子の研究
我々は、神経発生において中心的な役割を持つフロアープレート細胞に特異的に発現する遺伝子として、新しいスルファターゼSulfFP1/SulfFP2 を発見しました(Ohto et al. 2002; Nagamine et al. 2005 )。既知のスルファターゼの多くは、ライソゾームで硫酸化糖の分解を行う酵素であり、その欠損によりムコ多糖症や異染性白質ジストロフィーなどの遺伝性疾患が起こる事が知られています。我々が見つけたSulfFPは、細胞外で働く全く新しい分子であり、ヘパラン硫酸内部の6位の硫酸基を選択的に分解し、その硫酸化パターンを変化させることにより細胞外シグナルの調節に関わると考えられています。我々は、マウスやゼブラフィッシュなどを用いて生体内での機能を解析しています。
SulfFPは、ヘパラン硫酸内部の特定の硫酸基(グルコサミン残基の6-O位の硫酸基)を特異的に加水分解するエンドスルファターゼです。
SulfFP1遺伝子を同定した論文が、雑誌Genes to Cellsの表紙に取り上げられました。
参考文献:
- Ohto T et al. (2002) Genes to Cells 7: 173-186.
- 桝正幸、桝和子 (2004). 新規のヘパラン硫酸エンドスルファターゼによる細胞間シグナルの調節. 蛋白質核酸酵素 49 (15), 2376-2383.
- 桝正幸 (2005). 神経回路形成におけるヘパラン硫酸の役割. 神経研究の進歩 49 (1), 95-103.
- Nagamine S et al. (2005) Developmental Brain Research 159: 135-143.
- Masu M, Keino-Masu K. (2007) Role of heparan sulfate 6-O-endosulfatases in the nervous system. Neural Proteoglycans, pp. 103-114.
- 桝正幸 (2008). ヘパラン硫酸糖鎖による神経ネットワーク形成制御. 蛋白質核酸酵素. 53, 489-49.
- Nagamine et al. (2010) Biochem Biophys Res Commun 391, 107-112.
多機能分子オートタキシンの研究
オートタキシン(ENPP2とも呼ばれる)は、メラノーマ細胞の運動性を亢進させる分子として同定された分泌蛋白です。ENPP1やENPP3とともに ENPP (Ectonucleotide pyrophosphatase/phosphodiesterase) ファミリーを形成し、フォスフォジエステラーゼ活性を介して細胞外のヌクレオチド代謝に関わると考えられてきました。しかし、最近、オートタキシンが、 LysoPhospholipase D活性を持ち、細胞外のリゾフォスファチジン酸(LPA)の合成に関わることが明らかにされ、脂質メディエーターを産生するシグナル分子であると考えられるようになりました。オートタキシンは、細胞運動活性化、細胞増殖、血管新生などに関わる事が報告されていますが、生体内での働きは未だ明らかにされていません。我々は、ノックアウトマウスを用いて機能解析を進めています。
オートタキシンは、ENPP1やENPP3と同様に、II型の膜蛋白分子として産生された後、細胞外領域で蛋白分解を受けて分泌されと考えられてきました。しかし、我々の研究から、オートタキシのN末疎水性配列がシグナルペプチドとして働くことが明らかになり、オートタキシは膜蛋白ではなく、分泌蛋白として合成されることが分かりました(Koike et al. 2005)。 Enpp2 mRNAは卵黄嚢の臓側内胚葉細胞に強く発現しており、Enpp2ノックアウトマウスでは、この細胞のリソソーム形成が異常になることがわかりました。その原因は、LPA受容体の下流にある、Rho-ROCK-LIM kinase経路が障害された結果、アクチン繊維の脱重合が起こることを明らかにしました(Koike et al. 2009)。 この論文は、Nature Lipidomics Gatewayで注目すべき論文として紹介されました。
胎生8.5日齢マウス胎児の卵黄嚢臓側内胚葉細胞をLysoTracker Red(リソソームを特異的に染色する、赤)蛍光標識ファロイジン(重合したアクチン繊維を染色する、緑)で染色した図。Enpp2ノックアウトマウスでは、リソソーム形成が異常になる。
(Journal of Biological Chemistry誌の表紙になりました)
参考文献:
- Koike et al. (2005) Genes to Cells, 11, 135-143, 2006.
- Koike et al. (2009) Journal of Biological Chemistry 284, 33561-33570, 2009.
- Lipid Signaling: LPA’s ways of actin. Nature Lipidomics Gateway (2009).
- Koike et al. (2010) Biochemical and Biophysical Research Communications, in press.
Wnt活性化因子Ccd1の解析
我々は、ゼブラフィッシュの神経回路形成遺伝子として、Wntシグナル経路を活性化する新しい分子Ccd1を同定しました(Shiomi et al. 2003)。Ccd1は、N末にCoiled-coilドメインを、C末にDIXドメインを持つ分子であり、ヒトやマウスにも相同遺伝子が存在します。 DIXドメインは、WntのCanonical 経路におけるシグナル伝達に必須なDishevelledとAxinに見られる蛋白モチーフであり、Wntシグナル伝達に必要だと言われています。 Ccd1蛋白は、DIXドメインを持つ3番目の蛋白であり、DIXドメインを介してDishevelled、Axinと複合体を作り、Wnt経路を活性化することを明らかにしました。
ゼブラフィッシュの正常胚(左)、Ccd1を過剰発現させた胚(中央)、ドミナントネガティブ型Ccd1を発現させた胚(右)。いずれも、30時間胚(上段)と48時間胚(下段)の頭部側面 を 示します。Ccd1を過剰発現させると、眼球・頭部が小さくなり、逆にドミナントネガティブ型Ccd1を発現させると、眼球が大きくなり、色素形成が低下します。
マウスCcd1遺伝子には、転写開始点の違いと選択的スプライシングにより、14種類のアイソフォームが存在することを明らかにしました(Shiomi et al. 2005 )。Ccd1Aタイプは、N末にcalponin homology (CH) ドメインを持つ新しい蛋白であり、アクチンなどの細胞骨格と相互作用して働くと考えています。 最近、転写因子Sno-N1の下流で働き、小脳顆粒細胞の軸索伸長を促進していることが明らかになりました。
参考文献:
- Shiomi K et al. (2003) Current Biology 13: 73-77.
- Shiomi K et al. (2005) Molecular Brain Research 135: 169-180.
- Soma K et al. (2005) Gene Expression Patterns 6, 325-330.
- Ikeuchi Y et al. (2009) Journal of Neuroscience 29, 4312-4321.
運動神経軸索ガイダンスに関する研究
脊髄運動神経の軸索走行に以上をもつ突然変異体マウスを用いて、神経軸索ガイダンスの制御機構を個体レベル・遺伝子レベルで解析しています。
神経細胞移動の研究
中枢神経系を構成する神経細胞の多くは、誕生した場所から各々の標的へと移動し、神経回路を形成します。私たちは、小脳前核細胞の移動に着目し、神経細胞移動のメカニズムを明らかにすることを目指しています。小脳前核細胞は、脳幹部で核を形成し小脳へ投射する神経の総称です。胎児期に後脳背側部の下菱脳唇と呼ばれる神経上皮で誕生し、長い距離を移動した後、橋核、外側網様核、下オリーブ核などを形成します。
マウス胎児の下菱脳唇の神経前駆細胞に電気穿孔法を用いて緑色蛍光蛋白質を導入することにより小脳前核細胞を標識できます。このマウス脳を蛍光顕微鏡で観察することにより、小脳前核細胞が何時どこを移動するか、細胞がどんな形をしているか、どこで核を作るかを調べることができます。 この方法で標識した神経細胞は大人になってからも蛍光を発するので、小脳へ投射している神経線維の投射の様子を可視化することもできます。(左:この論文の図がNeuroscience Research 誌の表紙になりました)






