1981年以降、日本人の死因の第1位はがんで、現在、ふたりにひとりはがんに罹患し、3人にひとりはがんで亡くなる時代になっています。今後も、がんで亡くなる人は斬増しつづけると予想されており、がんを克服することは、日本人の健康を保つために、最も重要な研究課題となっています。
がんとは、『多細胞生物個体をつくっている細胞が、ゲノムの異常によって自律的に増殖するようになり、さらに、本来その細胞が存在する場所を超えて、浸潤・転移する性質を獲得したもの』と定義できます。がんは、ゲノムの異常またはエピジェネティカルな異常が複数重なって、多段階に進行します。がんの元となる1個の異常な細胞が発生してから、病院で発見される位まで進行するのに、通常20年位かかっていると言われています。ヒトのがんは、がんとしての共通の性質をもっていますが、ひとりひとりのがんの性質は、進行の速さにしても治療に対する反応性にしてもとても多彩です。このようながんの個性は、がんの発生母地となる細胞の性質の多彩さに加え、がんの発生と進展に関与しうる遺伝子が多く、がん細胞がもっている異常の組み合わせが大変多彩であるところに起因していると考えられています。また、がんに罹った患者さんの栄養状態や免疫力など、がん細胞に対する抵抗性の強さも関係すると考えられます。
私達の研究目的は、がんとはどういう病気かを明らかにし、がん細胞を特異的に傷害する方法を確立することにあります。そのためには、がん細胞がもっている異常を分子のレベルで明らかにし、その異常を標的とした治療法を開発することが有効です。分子のレベルで見るとがんがもつ異常は多彩なのですが、それでもヒトのすべてのがんの50%にp53遺伝子の異常があるとか、慢性骨髄性白血病の90%以上でabl(エーブルと読みます)の異常な活性化を起こす染色体転座があるとか、比較的多くの患者のがんに共通に見られるゲノムの異常があることも事実です。私達は、なるべく多くの患者さんにあてはまる研究をしたいと思っており、ほとんどすべてのヒトのがんで、トランスフォーミング増殖因子β(TGF-β)のシグナル伝達と標的遺伝子の転写調節に何らかの異常があるということに注目しています。
TGF-βの機能は多彩で、作用を受ける細胞の分化の違いなどによって異なった反応を惹起します。例えば、上皮細胞や血球・リンパ球の増殖抑制、アポトーシスの誘導、細胞分化・活性化(不活化)、血管新生の促進、細胞外マトリックス蛋白の合成促進などがあります。がん細胞においては、TGF-βのシグナル伝達に関与する受容体やSmadという細胞内シグナル伝達分子のゲノム異常が数多く報告されており、これらの異常が、増殖異常の発生や浸潤・転移能の獲得などに関与していることが示されています。
幹細胞性誘導が、がん細胞の持続的な増加をもたらす

筑波大学医学医療系実験病理学
加藤 光保
| 造血組織、表皮、粘膜上皮などの正常組織の細胞総数は、生まれる細胞と死ぬ細胞の数の動的平衡が保たれて一定の数に維持されています。私は、この機構が破綻して、がん細胞集団が持続的に細胞総数を増加し続けるようになる機序について検討し、がん細胞の一部で幹細胞の特性が獲得される幹細胞性誘導がその重要な機序であることを示しました。現在、幹細胞性誘導を標的として、再発のないがん治療を確立することを目指しています。 |
● はじめに
がんは、ゲノムDNAに異常が蓄積して発生しますが、多様なゲノム異常を原因として発生するがん細胞が共通に持続的な増殖を示す様になる過程には、多くの患者のがんで共通に働いている病理発生機序も存在しています。私は、多くのがん組織で共通にトランスフォーミング増殖因子β(TGF-β)が活性化していることから、この因子の関連分子がどのようにがんの発生と進展に関与しているのかについて検討し、増殖が停止しているがん細胞に幹細胞の性質を誘導することで、がん細胞の持続的な増殖をもたらすことを見い出しました。がん幹細胞とは、がん細胞集団の中にごく少数だけ存在している細胞で、自己複製と分化する能力を持ち、治療抵抗性や転移・再発の元になる細胞です。
● がん細胞はなぜ増え続けるのか
がん細胞は、ブレーキが壊れてアクセルが踏みっぱなしの自動車に例えられ、このために持続的に増え続けると言われてきました。しかし、がん細胞集団は分裂増殖している細胞と増殖が停止している細胞が混在した不均一な集団で、多くのがん細胞は短い寿命で細胞死に至りますが、がん細胞集団全体としては数が増え続けることがわかってきました。私達の体をつくっている造血組織、表皮、粘膜上皮などは、通常は増殖が停止していて間欠的に分裂増殖する組織幹細胞が一定の数に維持され、そこから生まれる一過性増幅細胞が連続して分裂増殖することで数を増やし、幹細胞以外の増加した細胞は全て最終分化して機能した後に細胞死に至りますが、この生理的再生の機構そのものが細胞総数を一定に保つ制御機構になっています。一方、がん細胞集団は、集団をつくる細胞の数がある程度以上に増えると、増殖が停止しているがん細胞の一部が幹細胞の性質を獲得する幹細胞性誘導が起こる頻度が細胞数に比例して亢進するため、がん幹細胞の数が持続的に増え続けるようになり、がん細胞集団全体の細胞数も加速度的に増え続けるようになると考えられます。
● がんを治療しても転移や再発が起こるのはなぜか
がんは、細胞総数が増え続ける病気です。現在のがん治療は、抗がん剤も放射線治療も主に分裂増殖している細胞を標的としています。ところが増殖が停止しているがん幹細胞は、これらの治療に抵抗性をもち、血液中に浮かんで流れる様なストレスにも耐性を獲得して、転移や再発を起こします。がんを治療しても転移や再発が起こるのは、増殖が停止しているがん幹細胞が治療後も生き残ってしまうからなのです。がん幹細胞も組織幹細胞と同様に増殖が停止していることが多く、間欠的に起こる分裂増殖ではゆっくりしか増えられない細胞です。しかし、がん細胞集団の細胞数が大きくなると増殖が停止したがん細胞の一部が幹細胞性を獲得するという確率的現象が安定して起こり、がん細胞集団の細胞総数は一気に増え始めることが明らかになってきました。この増殖が停止しているがん幹細胞が離れた臓器に流れ着いて転移を起こし、治療に抵抗して再発を起こすのです。
● 幹細胞性誘導を標的とする新たながん治療方法の開発に向けて
がん幹細胞を標的とするがん治療は世界中で研究が進められていますが、まだ臨床開発されたものはありません。がん幹細胞は正常な組織幹細胞との共通点が多いので、安易にこの細胞を叩けば修復不可能な正常組織の傷害を起こしかねません。したがって、正常な組織幹細胞とがん幹細胞で起こっている現象をしっかりと見分けることが重要で、がん幹細胞の数は持続的に増え続けるということです。正常組織でも胎児期、発達期、損傷された組織の再生時には、幹細胞の数が増えることが知られていますが、大人の体の中では、組織幹細胞の数は一定に維持されています。従って、組織幹細胞の数を一定に保つ機構には影響を与えず、がん幹細胞が増加するのを防ぐ方法として、幹細胞性誘導によってがん幹細胞が急速に増加する機構を標的とする治療方法の開発を進めています。これを実現するためには、この現象が分子のレベルでどの様に誘導されているのかを詳細に解析することが重要で、現在まで私達の研究は、この点について着実に成果をあげてきました。
● どうすればがんの発症をなくせるか。
がんが発症する原因は、ゲノムDNAが損傷されて異常が蓄積することです。そして、ゲノムDNAが損傷されることを防ぐことは現状では困難であると言わざるを得ません。しかし、ゲノムDNAの一部が損傷されて、がん化のプロセスを開始した細胞が病院で見つかる段階にまで進行するのには、通常10年から30年程度かかることが知られています。この前臨床段階にあるがん細胞で何が起こっているかを詳細に検討して、この過程に必要な時間を、例えば3倍位に遅延させて30年から100年かかるようにできれば、現在、死因の第一位であり続けているがんの多くを、ヒトの寿命が尽きるまで臨床的に問題にならない位ゆっくり進行するものにすることが可能だと考えています。この時期のがん細胞集団の主役も増殖が停止しているがん細胞です。幹細胞性誘導を中心に増殖が停止しているがん細胞の研究を推進し、その増加速度を3倍以上遅延させることが、がんの発症を寿命の範囲の外に追いやるための、今後のがん研究の中心課題になると考えています。
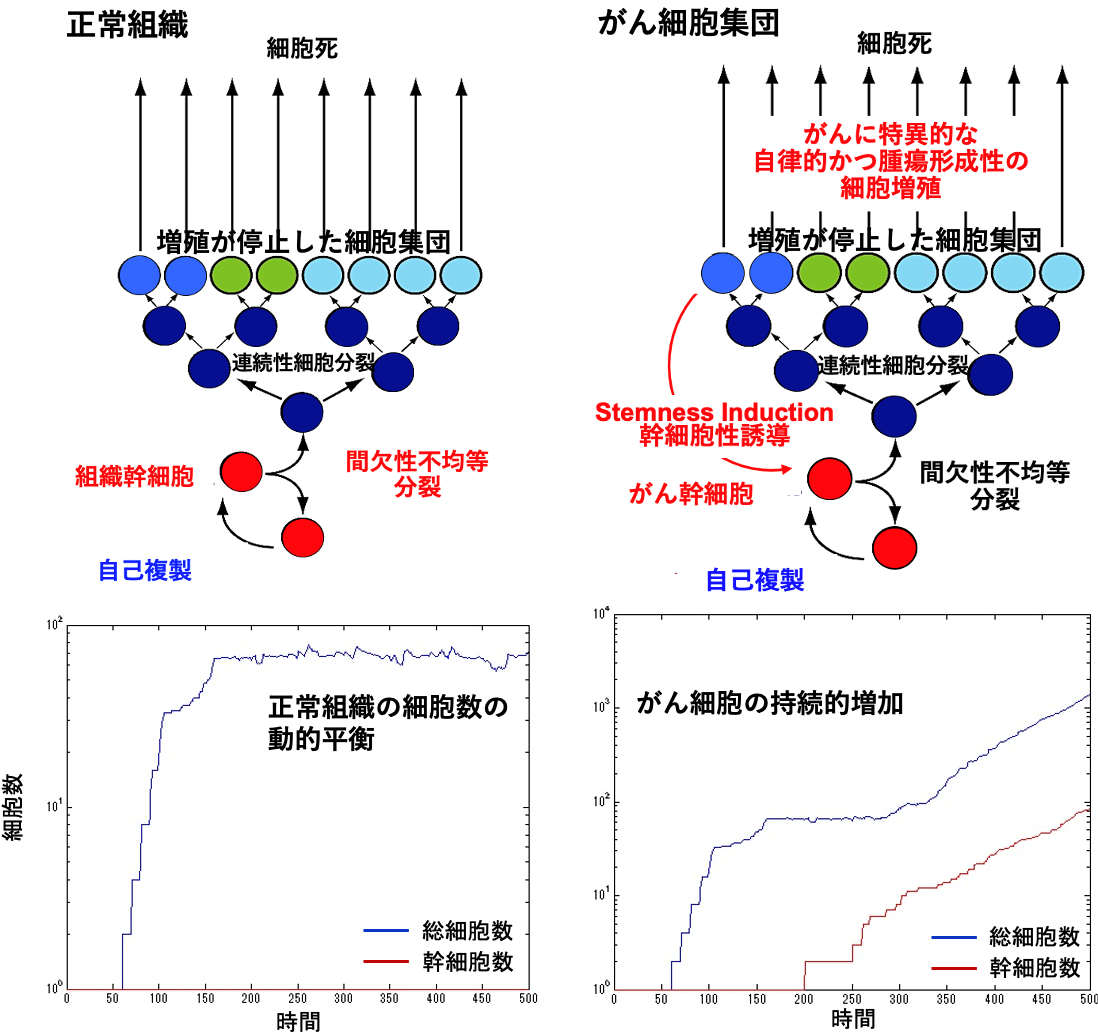
図 正常組織(骨髄造血組織、表皮、粘膜上皮など)の生理的再生における細胞総数
の動的平衡(左)とがん細胞集団の持続的増加の機序(右)
第109回日本病理学会 宿題報告(令和2年度日本病理学賞)
「幹細胞性誘導によるがんの持続的増殖機構」
