|
貝淵弘三 (名古屋大学大学院医学研究科)
研究の背景
神経細胞は高度に発達した極性を有する細胞である。神経細胞は細胞体から通常1本の軸索と複数の樹状突起を伸長させる。樹状突起は神経伝達物質受容体を介して受け取ったシグナルを電気的インパルスに変える部位として、そして軸索は遠く離れた他の神経細胞へ電気的インパルスを伝達する部位として機能する。2つの突起はその機能を遂行するために、特殊化した形態と構造を発達させていく。たとえば、軸索はその先端にシナプス小胞を蓄積したシナプス終末を、樹状突起は神経伝達物質受容体などが濃縮し、シナプス終末からの情報を受け取るために特殊化したシナプス後膜(postsynaptic
membrane)を有するようになる。軸索と樹状突起は、その形態のみならず蛋白質構成(細胞骨格、細胞膜蛋白質など)にも互いに違いがあることが知られている(
Craig, A.M., and Banker, G. Annu Rev Neurosci 17, 267-310, 1994)。一つの細胞内に軸索と樹状突起という構造的、機能的に異なる特殊化した2つの領域をもつことによって、神経細胞内を伝達するシグナルの流れには方向性が生じる。脳内の複雑な神経回路網もこの神経細胞のもつ極性の上に成り立っていると考えられる。神経細胞が極性を獲得、維持していく過程には、まだ解決されていないいくつか基本的な疑問が残っている。軸索、樹状突起とも最初は区別のつかない未成熟な神経突起から形成されていくが、どのような分子メカニズムによって軸索もしくは樹状突起への運命決定がなされるのだろうか。また、どうして複数ある突起のうち1本のみが軸索となるのだろうか。
神経細胞の極性形成を研究するために、ラット胎児脳から得られる海馬神経初代培養細胞(以下、培養海馬神経細胞)が古くからよく用いられている。培養海馬神経細胞は生体脳における神経細胞と同様に再現性よく、1本の軸索と複数の樹状突起を持った極性を発達させる。さらに、長期間培養すると神経細胞間でシナプスを形成するようになる。この極性の形成過程は図1に示すようにBankerらによって5つの段階に分けられている
( Dotti, C.G., et al. J Neurosci 8,1454-468, 1988)。培養ディッシュに付着してから間もない神経細胞では、細胞の辺縁にラメリポディアが形成される
(stage 1)。その後(培養開始後12時間以内)、4-5本の短い(15-25mm)神経突起(neuriteまたはminor processとも呼ばれる)が細胞体から伸長する(stage
2)。この段階の神経突起はその形態、蛋白質構成、伸長速度において互いにほぼ等価である。さらに12-24時間経過した次の時期(stage
3)になってはじめて形態上の極性が観察されるようになる。互いに区別のつかなかった神経突起のうちの1本が急速に伸長する。この急速に伸長した神経突起は軸索としての性質を有するようになる。その後(培養開始後3-4日)、残りの神経突起が伸長して樹状突起としての性質を獲得していく
(stage 4)。Stage 5は軸索と樹状突起のさらなる成熟とシナプス形成が起こる時期である。
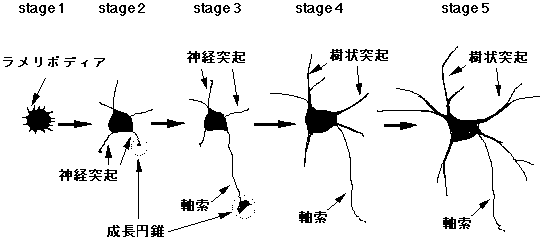
図1 培養海馬神経細胞の極性形成過程
Dotti, Sallivan, and Banker, 1988, J. Neurosci. 8, 1454-1468を改変。Stage
1, 培養開始後(以下同じ)0.25日;Stage 2, 0.5日;Stage 3, 1.5日;Stage 4, 3-4 日;Stage 5,
7日以降。詳しくは本文参照。
このようにして一旦確立した神経細胞の極性も不変ではなく、軸索や樹状突起として運命が決まったあともその運命は変わりうることが知られている(
Craig, A.M., and Banker, G. Annu Rev Neurosci 17, 267-310, 1994)。たとえば、stage
3の軸索を他の神経突起と同等の長さのところで切断すると、新しい軸索が他の神経突起から形成され、切断された部位からは樹状突起が形成される(
Dotti, C.G., and Banker, G.A. Nature 330, 254-256, 1987)。一方、軸索が他の神経突起よりある程度長い状態で切断された場合は、切断された部分から軸索が再び形成される。最近、stage
4の神経細胞の樹状突起も軸索切断によって、軸索へと変換しうることが示された ( Bradke, F., and Dotti, C.G.
Curr Biol 10,1467-1470, 2000)。なお、いずれの場合も新たに作られる軸索は1本である。これらの知見は、すべての神経突起が軸索になりうる能力を有していること、また、軸索や樹状突起の運命決定が神経細胞の分化の初期段階のみでなく、成熟した神経細胞でも起こりうることを示している。
研究成果
筆者らの研究室では最近、脳内における低分子量G蛋白質Rhoのエフェクター蛋白質Rhoキナーゼの新規基質蛋白質を探索し、collapsin
response mediator protein-2 (CRMP-2) を見出した( Arimura, N., et al. J Biol
Chem 275,23973-8039, 2000)。CRMP-2は発生時期の神経組織で高レベルに発現しており、反発性のガイダンス因子であり成長円錐を退縮させるSemaphorin
IIIの細胞内シグナル伝達に関与する分子として同定された( Goshima, Y., et al. Nature 376, 509-1440,
1995)。またCRMP-2の線虫ホモログであるUNC-33の変異体では軸索ガイダンス に異常が起こることが報告されている。今回我々はさらにCRMP-2の機能を解析する過程で、CRMP-2が神経細胞の軸索形成において重要な役割を担うことを見出した(Inagaki
et al. Nature Neurosci. 4, 781, 2001)。Stage 3以降の培養海馬神経細胞においてCRMP-2は軸索のより遠位部分に濃縮して存在し、明らかに細胞内における局在に極性がみられた(図2)。CRMP-2を培養海馬神経細胞で過剰発現させると、一次軸索が長く伸長するとともに、軸索様突起が複数形成された(図2)。この軸索様突起はいづれも軸索マーカーであるtau-1抗体による染色が陽性で、また他の神経細胞の樹状突起との間にシナプスを形成しうることから、軸索の性質を有していることが分かった。CRMP-2を過剰発現させると、すでに成熟した樹状突起をも軸索に変換した。さらに、CRMP-2のC末側を欠いたあるフラグメントを発現させると、軸索伸長が阻害され、ある細胞では軸索形成が抑制された(図2)。以上の結果から、CRMP-2が未成熟な突起の軸索への分化誘導に必要かつ十分であり、神経細胞の極性形成に重要な役割を果たす可能性が示唆された。また、CRMP-2が軸索に濃縮して樹状突起には低レベルしか存在しないことが、神経細胞が不必要な軸索の形成を抑制してその極性を維持するうえで重要であるものと考えられる。
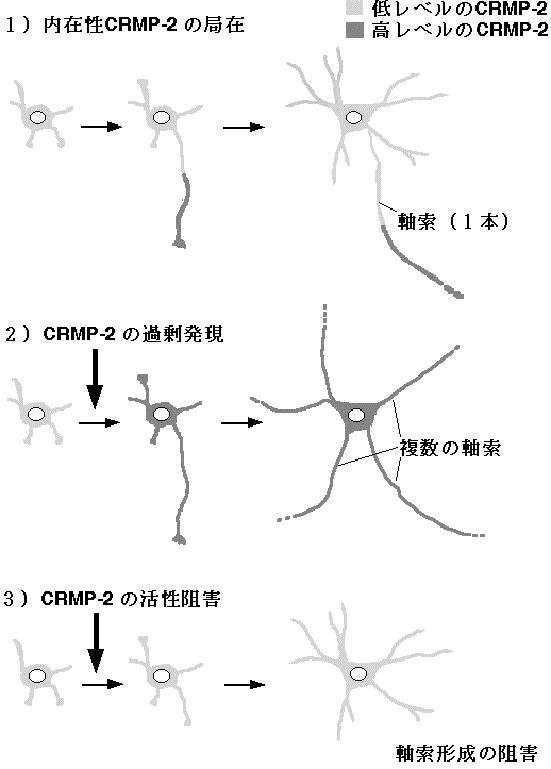
図2 CRMP-2による軸索運命決定
1) Stage 3以降の培養海馬神経細胞においてCRMP-2は軸索のより遠位部分に濃縮した。2)CRMP-2を培養海馬神経細胞で過剰発現させると、軸索様突起が複数形成された。3)CRMP-2のC末側を欠いたあるフラグメントを発現させると、軸索形成が抑制された。これらの結果はCRMP-2が軸索の運命決定において重要な機能を果たすことを示している。
考察
現在までに、CRMP-2以外に過剰発現によって軸索形成を誘導できる蛋白質は報告されておらず、CRMP-2は軸索の運命決定において重要な機能を担っていることが示唆された。CRMP-2は軸索・樹状突起の運命決定機構を理解する上での有力なてがかりとなる。そこで我々は、CRMP-2の軸索形成における作用機構を明らかにするために、CRMP-2結合蛋白質を探索している。その結果、CRMP-2結合蛋白質の一つとしてチューブリンを同定した(Fukata
et al. , 投稿準備中)。CRMP-2は通常4量体(テトラマー)として存在するが、チューブリン共存下ではモノマーとしてチューブリンダイマーに直接結合し、微小管のassemblyを促進することが分かった。現在までに、CRMP-2以外にチューブリンダイマーに結合して微小管のassemblyを促進する蛋白質は報告されていない。CRMP-2は軸索の遠位部分に濃縮し、そこでチューブリンと結合することによって、微小管のassemblyを促進し軸索形成を制御している可能性が高い。軸索形成におけるCRMP-2の活性制御因子についてもまだ不明であるが、Rho/Rho-キナーゼ経路はCRMP2をリン酸化することによって微小管に対する作用を抑制し、軸索伸長に対して抑制的に働く可能性も考えられ、現在解析しているところである。CRMP-2の作用機構、活性制御機構、軸索への局在化機構などが明らかになれば神経細胞の極性形成の分子メカニズムの一端を理解できると考えられる。
おわりに
本稿では、神経細胞の極性形成を制御すると考えられる細胞内のメカニズムについて述べてきた。最近の研究によって、極性形成の最初のステップである軸索の運命決定には細胞膜輸送と細胞骨格のダイナミックな変化が伴うことが明らかになってきた。しかしながら、まだまだ多くの疑問が解明されずに残っている。たとえば、神経細胞の極性決定は外界からの影響を受けないのだろうか。培養海馬神経細胞ではある1本の神経突起が偶然に選択されて軸索になり(a
stochastic process)、この選択には細胞外シグナルは関与していないと考えられている。しかし、生体脳においては、細胞外のシグナルがなんらかの形で軸索の運命決定に関与するものと考えられる。本稿では述べなかったが、成長円錐と細胞外基質との接着を介したシグナル伝達も細胞骨格を変化させ神経突起の伸長や軸索形成を制御するだろう。次に、いつ、どのようにして軸索と樹状突起における蛋白質の局在化がおこるのだろうか。CRMP-2は軸索に濃縮するが、この濃縮が軸索形成に必要なのかそれとも軸索形成の結果なのかはまだ不明であり、我々はCRMP-2の軸索への局在化機構を明らかにすべきであると考えている。極性形成のモデルとしての酵母や上皮細胞における知見からも何らかのヒントが得られるであろう。
謝辞
本稿でのべた研究は、東京大学大学院医学系研究科 井原康夫先生、横浜市立大学医学部 五嶋良郎先生、名古屋大学大学院理学研究科 伊藤知彦先生、宝谷紘一先生らとの共同研究によるものです。ここに感謝いたします。
|


