高橋良輔 (理化学研究所脳科学総合研究センター)
1. 研究の背景
パーキンソン病はアルツハイマー病に次いで患者数の多い神経変性疾患であり、日本国内での患者数は約12万人と推定される。振戦(手足の震え)、無動(運動の緩慢化)、固縮(筋肉が固くなる)といった運動障害が年余に渡って進行し、末期には寝たきりになるという経過をたどる。神経病理学的には中脳黒質のドーパミンを産生する神経の選択的変性脱落が特徴である。パーキンソン病にみられる障害は大脳基底核神経回路の重要な神経伝達物質であるドーパミン欠乏症状として理解でき、ドーパミン補充が症状を改善する対症療法としては有効であるが、神経変性の進行をくいとめる方法はみつかっていない。
ほとんどのパーキンソン病は孤発性(非遺伝性)であるが、約5%の患者には家族歴があり、遺伝性と考えられる。パーキンソン病の原因を探るうえで、遺伝性パーキンソン病を対象とした場合、病因遺伝子という確固たる物質的基盤に基づいて研究をすすめられる強みがある。我々はこのような観点から、常染色体劣性遺伝性若年性パーキンソニズム(AR-JP)の分子機構の理解に焦点を絞り、パーキンソン病の研究を行っている。
AR-JPは40才以下で発症するパーキンソン病様症状を主体とする疾患で、神経病理学的には黒質・青斑核の選択的変性を特徴とする。しかし孤発性パーキンソン病の特徴とされるレビー小体は通例観察されない。AR-JPはその概念の確立から病因遺伝子の単離に至るまで、日本の神経学者が主導的な役割を果たしてきた疾患である。まず1973年、山村安弘ら(現広島大)により家族歴を有し、若年で発症するパーキンソン病の一群の患者が記載された。その後、1996年、石川厚と辻省次(新潟大)が、多数の家系を集積して、AR-JPという疾患概念を提唱した。遺伝子同定への過程も日本のチームが先行した。新潟大・順天堂大チームにより、第6番染色体に遺伝子座が決定され、1998年、慶応大・清水信義、順天堂大・水野美邦らの共同チームにより、病因遺伝子としてパーキンが同定された。
パーキンはN末端にユビキチンホモロジー領域、C末端に2つのリングフィンガー領域を有するタンパク質であった。発見当初、パーキンの機能は不明であったが、昨年、東京都臨床研・田中啓治、順天堂大・水野美邦らの共同チーム、次いで理研運動系神経変性研究チーム、米国ジョンスホプキンス大の計3チームによってパーキンがユビキチンリガーゼ(略称:E3)というユビキチンプロテアソーム蛋白分解系に関わる酵素であることが示された。E3の役割は分解されるべき蛋白質をユビキチン化し、プロテアソームによる分解へと導くことである。AR-JPでは変異によってパーキンのE3活性が欠損することから、パーキンが本来分解すべき基質がドーパミン神経に蓄積し、神経変性を引き起こすと考えられる。すなわちパーキンの基質を明らかにすることがAR-JPの発症メカニズム解明への鍵と考えられるに至った。今回我々は順天堂大・服部信孝、水野美邦との共同研究でAR-JPの発症に重要な役割を果たすと考えられるパーキンの基質の同定に成功した。
2.成果
我々は酵母two-hybrid法でパーキン結合蛋白としてリガンド未同定のGタンパク共役型受容体、パエル受容体(Pael; Parkin
associated endothelin receptor-like)を同定し、以下のことを明らかにした。
- パエル受容体はパーキンのE3作用によってユビキチン化され、プロテアソームによって分解される。
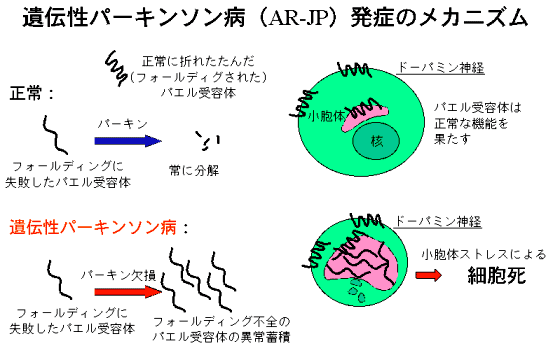
- パエル受容体は正常な形に折れたたむこと(フォールディング)が難しいタンパク質であり、フォールディングに失敗したパエル受容体は、パーキンの作用ですみやかに分解される。
- 培養細胞での実験では、プロテアソームを阻害し、フォールディング不全のパエル受容体が分解されなくなると、小胞体に異常蓄積し、細胞は小胞体ストレスによる細胞死に陥る。
- パエル受容体は、AR-JPの患者脳で分解されずに、非AR-JP対照脳の10-30倍以上蓄積している。
- パエル受容体は、脳のオリゴデンドログリア細胞に強く発現し、一般的には神経細胞での発現は乏しいが、AR-JPの病変部位である中脳黒質のドーパミン神経では例外的に強く発現している。
これらの事実から、AR-JPではフォールディングに失敗したパエル受容体の異常蓄積により、ドーパミン神経が選択的に細胞死に陥って発症に至るのではないかと考えられる(図)。
3. 今後への期待
本研究によりパエル受容体をターゲットとしてAR-JPドーパミン細胞の変性を防ぐ治療法が生み出されることが期待される。具体的にはパエル受容体の産生を抑えたり、また分解を促進することでAR-JPの治療が可能になるだろう。また本研究によって孤発性のパーキンソン病においても、パエル受容体のようにフォールディングが困難なタンパク質の神経細胞への異常蓄積が神経変性の原因になっている可能性が新たに提示された。この可能性を追究することで全く新しい観点からパーキンソン病の根治療法がうまれる可能性がある。
4. おわりに
本論文と同時期にハーバード大、順天堂大の共同チームにより、糖化されたα-シヌクレインがパーキンの基質になるという発表がなされた(Shimura
H, at al. Science, 293, 263-9, 2001.)。α-シヌクレインは孤発性パーキンソン病に特徴的な封入体であるレビー小体の主要構成成分であり、その変異はまれな常染色体優性遺伝性パーキンソン病の原因となる。AR-JPと孤発性パーキンソン病の関連を示唆する発見として興味深い。また糖化α-シヌクレインがドーパミン神経変性にどのように関与するのか、今後の展開が注目される。
アルツハイマー病、ポリグルタミン病などの神経変性疾患の統一仮説として、異常蛋白質の蓄積を原因とする考えが最近有力であり、今回のAR-JPの研究でもその考えを支持する証拠が得られた。「溜まって殺す」ことが共通する事実だとすれば、個々の疾患で「なにが」「どこで」「どのように」を明らかにすることが、今後の神経変性疾患研究の最重要課題となるだろう(本文中の敬称略)。
|

