| 佐藤 真(福井医科大学・解剖学2)
1.研究の背景
6層からなる大脳新皮質は、それぞれの層が異なる役割を担い、高次機能を実現するが、この6層がどのように形成されるかは、現在の神経発生学のホットなテーマである。脳室帯(神経上皮)にて生まれた神経細胞は,脳室帯を離れ移動し大脳皮質を形成する。特に興奮性の神経細胞は、大脳皮質内の脳室帯にて生まれ、脳室帯より出て放線方向に移動・定着し、大脳皮質の構成細胞となる。脳室帯からの移動開始は、それぞれが将来担うであろう層ごとに異なり、深層の層を構成する細胞(すなわちVI層の細胞)から発生に従い順に移動を開始することが知られている。つまり各層の運命づけがなされ、それに応じて細胞は移動を開始する。移動開始は層形成の重要なポイントであるが、従来よりその知見は乏しかった。脳室周囲に第二の皮質を有するperiventricular
heterotopia病の解析を元に、アクチン結合蛋白フィラミンA(フィラミン1)がこの脳室帯からの移動に必須であるとの報告は知られていたものの、層形成に係る細胞移動の最終段階、特にその移動停止の仕組みについて、リーリンやその受容体・細胞内情報伝達系に関する研究が多くの研究者により活発に進められてきたことと好対照をなしていた。
今回我々は、形成期の大脳皮質脳室帯に発現する新規分子FILIPを同定し、FILIPがフィラミンAの分解を促進することで、脳室帯からの細胞移動開始を負に制御している仕組みを見いだし報告した。
2.研究の概要
我々は、Differential display法を用い、胎生期の後期に大脳皮質脳室帯に強く発現するFILIPをクローニングした。FILIPには、短いS-FILIP(アミノ酸965残基)と、そのN端側に新たに247残基のアミノ酸が加わった、長い形のL-FILIPが存在した。
機能を検討するため、S-FILIP、L-FILIPをCOS-7細胞にて強制発現させると、細胞内でアクチン線維と共存した。但し、L-FILIP発現細胞の多くではアクチンが線維状形態を示さず、斑点状に存在しており、その場合には明瞭な共存は観察されなかった。
この共存に関し、FILIPの部分欠損分子を用いた解析の結果、S-、L-FILIP共通のC端側にてアクチン線維と共存することが判明した。そこで、yeast
two-hybrid法を用い、結合分子を検索したところ、アクチン結合分子フィラミンAが得られた。フィラミンAとの結合は免疫沈降法や免疫細胞化学によっても確認し、FILIP(S-FILIP、L-FILIP)は、フィラミンAを介しアクチン線維と共存するものと考えられた。ちなみにFILIPとは、フィラミンAに結合することにより、Filamin
A-interacting proteinの下線部をとり名付けたものである。
従来よりフィラミンAは細胞移動に必須であることが報告されていたが、特にL-FILIP発現細胞にて主に観察されたアクチン、フィラミンAの斑状分布は、FILIPが細胞レベルでその移動に何らかの影響を及ぼすことを示唆した。そこで、S-FILIPやL-FILIPを発現させた細胞の移動度を検討すると、これらFILIPの発現により大きく細胞移動が障害されている様子が観察された。さらに、これらの細胞では葉状仮足(lamellipodia)の形成率が大きく減少していた。減少の程度はL-FILIPで特に顕著であった。葉状仮足の形成低下により、移動が障害されるものと考えられた。
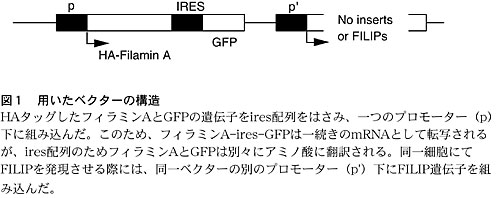
FILIPの発現により、フィラミンAが欠損した場合と同様の結果(移動障害)が観察されたことは、FILIPによりフィラミンAの動態が大きく変化し得る可能性を示唆する。そこで、図1に示すベクターを作製し、GFPの発現量により、そのmRNA量(これはフィラミンAのmRNA量と共通)を標準化し、すなわちフィラミンAのmRNA量を標準化し、FILIPの有無によるフィラミンAの蛋白量の変化を検討した。すると、FILIP(特にL-FILIP)の存在下では、その量が大きく減少していた。この変化はcalpeptin(calpain
inhibitor)では抑制されたが、proteasome inhibitor MG-132では抑制されなかった。calpainはカルシウム依存性のproteaseであるが、この変化はカルシウムキレート剤BAPTA-AMでも抑制された。さらに、L-FILIPを発現させた細胞と、何も発現させていない細胞との間で内在性のフィラミンの発現を比較すると、前者において、その発現が顕著に減少している例も免疫細胞化学的に確認した。
さらに、FILIPの実際の大脳皮質形成時における役割を探るため、発生期の大脳皮質においてフィラミンAのmRNAと蛋白量をin situ hybridization法と免役組織化学法により検討した。その結果、確かにFILIPの発現する脳室帯においては、顕著なmRNA発現にも関わらず、他の部位に比しフィラミンA蛋白の存在量が減少していることが確認された。又、この時期の大脳皮質内においてL-FILIPとフィラミンAが結合していることも、免疫沈降法により確認できた。
では、脳室帯に発現しているFILIPの、正常脳形成における機能は何であろうか?periventricular heterotopia病の解析から明らかなように、フィラミンAがずっと存在しないのであれば、分裂後の神経細胞は脳室帯から外に動き出すことはできないはずである。我々は脳室帯においてFILIPの発現(もしくは作用)が低下し、フィラミンAが一定量以上となったものが、脳室帯からの移動を開始するのではないかとの仮説を立てた。すなわち、これから移動しようとする細胞にFILIPを強制発現させると、移動が止まり脳室帯に留まるのではないかと考えた。そこで、ラット大脳に脳室側よりFILIP発現ベクターを遺伝子導入し、脳を切り出し器官培養を行い、FILIPを発現する細胞がどのような挙動を示すかを検討した。その結果、FILIP(特にL-FILIP)を発現した細胞において顕著な移動抑制が観察された。
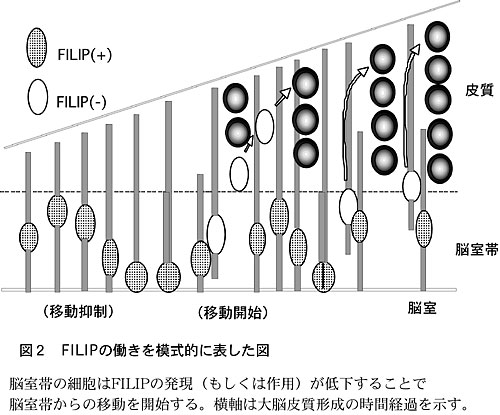
以上のことより、脳室帯からの細胞移動は、FILIPが脳室帯においてフィラミンAの分解を促進することで負に制御されており、FILIPの発現(もしくは作用)が低下することで移動が開始されるものと考えられた(図2)。
3.おわりに
精緻にコントロールされている細胞骨格系の制御において、FILIPがその結合相手であるフィラミンAそのものの分解を促進する(即ちアクチン結合蛋白そのものをなくす)という現象は、あまりにも大胆であり、その事実は私にとり驚きであった。
全くの飛躍であるが、私は脳室帯からの細胞の移動開始は、自動車を発車させる場合になぞらえると解りやすいのではないかと思っている(自動車を運転されない方ごめんなさい)。自動車を動かす場合には、フットブレーキを踏んだままエンジンをかけ、ドライブモードにシフトし、パーキングブレーキを解除し、フットブレーキからアクセルに足を移し、アクセルをふかしハンドルで進行方向を決め発車させる。これら一連の作業があり、自動車は動き始める。同じようなステップを細胞は踏み、脳室帯から移動を始めるのではないか?根拠があるわけではないが、私には、FILIP-フィラミンAの系は、その仕組みの大胆さから考えて、いわばパーキングブレーキのような安全装置に相当するものと思えて仕方がない。(やはりFILIPが関係するかもしれないが)この移動開始においては、例えばフットブレーキとかアクセルに相当する、もっと精緻な制御機構が存在する可能性をどうしても考えてしまう。この点に関しては、現在のところ、FILIPのノックアウトマウスやFILIP分子へのリン酸化などの影響を検討することで何らかの答えが出るのではないかと期待している。いずれにしても、層の運命づけから方向性を持った‘発車’までの一連の過程を、FILIPを一つの軸として、解明できたらと願っている。
謝辞
Differential display法を用いた検索とS-FILIPのクローニングには米田託成先生(当時大阪市立大学)、L-FILIPのクローニング並びにFILIPの機能解析全般には永野隆先生(福井医科大学),in
situ hybridizationには久保田力先生(福井医科大学)、器官培養を用いた機能解析には畠中由美子先生(基礎生物学研究所)・村上富士夫先生(大阪大学)が多大な貢献をされました。本研究はこれら諸先生方との共同研究です。ここに改めて謝意を表します。
|