|
|
「シヌクレイノパチー脳に蓄積したα-シヌクレインはリン酸化を受けている」
|
|||||
| 岩坪 威 (東京大学大学院・薬学系研究科・臨床薬学教室) 神経変性疾患においては、疾患ごとに一定の組み合わせでニューロンが脱落するとともに、残存ニューロンにはしばしば特徴的な線維性封入体が形成されることが知られてきた。封入体の形態や構成蛋白は疾患ごとに異なるが、特に遺伝性を示す病型では、病因遺伝子そのものの産物蛋白(たとえばポリグルタミン鎖など)が凝集・蓄積する例が相次いで報告された。このことから、変異によりコンフォメーション異常をきたして蓄積した蛋白が毒性を獲得し(孤発例では野生型蛋白に類似の変化が生じることも考えられる)、神経細胞死の原因となる可能性が論じられている。このような変性疾患の病因解明を目標として行われてきたアプローチの一つが、封入体の精製と生化学的解析-いわゆるbody
chemistry-である。振戦、固縮、無動などの運動障害を主症状とするパーキンソン病(PD)、変動の激しい痴呆・精神症状を特徴とするLewy小体型痴呆症(dementia
with Lewy bodies;DLB)はいずれも頻度の高い変性疾患であるが、これらに共通に見られる神経細胞内封入体がLewy小体(LB)である。筆者らはLBの構成成分に興味を持ち、DLB大脳皮質を出発材料として、直径10ミクロン内外の球状を示すLBを、ユビキチン等既知の成分に対する免疫蛍光染色を施すことにより、セルソーターにより単離・精製する方法を確立した[1]。LBの構成成分を調べるにあたって、得られたLBを直接蛋白化学的に解析することは、難溶性で多様な成分を含むLBの緻密な構造を考えると困難であることが予想された。そこで、精製LBを抗原としてモノクローナル抗体を作製し、LBを陽性に染色する抗体が脳可溶画分中に認識する抗原を同定する”immunochemical
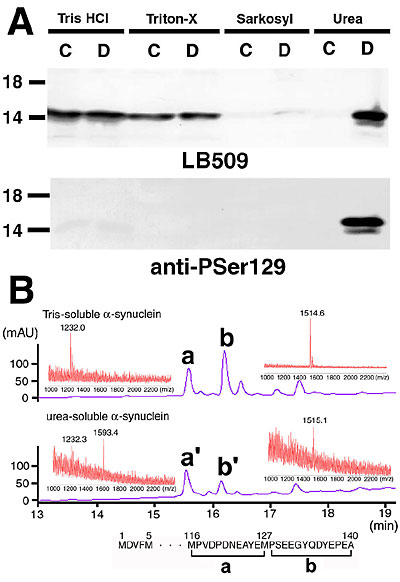
approach” をとることにした。数百万個のLBを単離した後に得られたLBを強く染色するモノクローナル抗体LB509は、脳可溶画分中の約15
kDaの蛋白を認識したが、この研究を遂行中の1997年、Polymeropoulosらにより常染色体性優性遺伝を示す家族性PD家系においてα-synuclein遺伝子の変異が報告されたこと[2]を契機に、LB509が認識するLB中の抗原はα-synucleinであることを確定できた[3]。α-synucleinは脳のシナプス前末端に豊富に存在する可溶性蛋白であり、その正常機能は未だ不明であるが、この蛋白が孤発例のPD,
DLBにおいても何らかの原因でコンフォメーション異常を生じ、神経細胞中に蓄積しつつ細胞死を導くことがsynucleinopathyにおける変性の本質的過程ではないかと考えられるようになった。
次にDLB脳から精製した不溶性α-synucleinを臭化シアンで切断し、分取した断片を質量分析で解析したところ、α-synucleinの最C末端13アミノ酸からなる断片が、正常より80 (=リン酸一個の質量数に相当する)多い質量数を示すことがわかった(図1B)。タンデムマスとリン酸化部位特異抗体を用いた解析を併用することにより、この修飾は129番目のセリン残基のリン酸化であることが判明した。正常ラット脳においてもα-synucleinはリン酸化を受けているが、その程度は4%前後に過ぎない。一方PD, DLBをはじめとするsynucleinopathyの脳に蓄積したα-synucleinは、死後の状態においても90%以上がリン酸化されており、凝集に際して何らかの原因によりSer129に特異的かつ高度のリン酸化が生じることに起因するものと考えられる(図1B, 2)。この部位をリン酸化するキナーゼの候補としては、in vitroの検討からカゼインキナーゼ1,2やG 蛋白結合型受容体キナーゼ(GRK)などが見出されている[4,5]。α-synucleinはin vitroで線維を形成する性質が知られていたが、CK2によりSer129をリン酸化したα-synucleinは線維形成能が亢進していることも確認された。α-synucleinのリン酸化は、脂質膜とα-synucleinの親和性を低下させることも示唆されており[5]、細胞質中の限局した部位におけるフリーなα-synucleinの濃度が上昇することが蓄積・線維形成の一因となる可能性もある。変性疾患に見られる蓄積蛋白の中で過剰リン酸化が最もよく知られ、注目されてきたのは、アルツハイマー病(AD)やタウオパチーにおけるタウ蛋白であるが、GSK3βをはじめとするタウリン酸化酵素とは異なるサブセットのキナーゼがα-synucleinのリン酸化に関わっており、両者は別個の蓄積物を形成することは興味深い(図2)。
リン酸化がこれらの蓄積物の形成に果たす真の役割は未だ不明であり、PDやADの病態を単純な「過剰リン酸化症」と捉えることは単純化に過ぎることも事実である。しかしα-synucleinには、リン酸化以外にも、酸化ストレスとの関連が考えられるチロシンニトロ化[6]や、ユビキチン・プロテアソーム系による分解を促進するというO-グリコシル化[7]などのさまざまな翻訳後修飾が見出されつつある。また我々は最近synucleinopathy脳に蓄積したα-synucleinがモノユビキチン化を受けている可能性を見出している(Hasegawa et al.投稿中)。神経変性におけるこれらの翻訳後修飾、そしてα-synuclein蓄積の意義を明らかにすることにより、PDをはじめとするsynucleinopathyの病態解明と根本治療法の創出を目指したいと考えている。 文献 |