|
|
「リガンド投与による代謝型グルタミン酸受容体細胞内領域の二量体構造の動的変化」
|
||||||
| 久保義弘、立山充博 (自然科学研究機構・生理学研究所・神経機能素子研究部門) 代謝型グルタミン酸受容体1型 (mGluR1) は、脳の様々な部域に発現している受容体で、この遺伝子を破壊したマウスは、海馬や小脳のシナプス伝達効率の可塑的変化の異常と、空間記憶や運動学習等において行動異常を示すことが知られている1,2)。このことから、mGluR1 は、いわば、記憶の鍵を握る重要な分子として注目されてきた。 近年、mGluR1 の細胞外領域の一部分の結晶を用いたX 線構造解析により、2つのサブユニットが会合しホモ二量体として構成されていること、それぞれのサブユニットはグローブ状の構造をしており、グルタミン酸結合によりグローブが閉じるように細胞外領域の構造が変化することが明らかにされた3)。ところで、代謝型受容体のシグナル伝達は、いうまでもなく細胞内においてG蛋白質を活性化することによりひきおこされる。そのため、mGluR1のシグナル伝達機構を理解するためには、細胞外領域の構造変化に伴って起こる細胞内領域の構造変化を知ることが必要であるが、この点は未解決であった。特に、ひとつのサブユニット内で構造変化がおこるのか、それとも、2つのサブユニット間の配置が変化するのかという点については、知見がなかった。そこで、我々は、光ラベルを用いた膜機能分子の動的構造変化解析という最先端の手法を用いてこの問題にアプローチした4)。
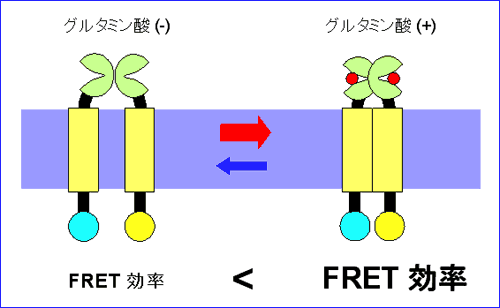
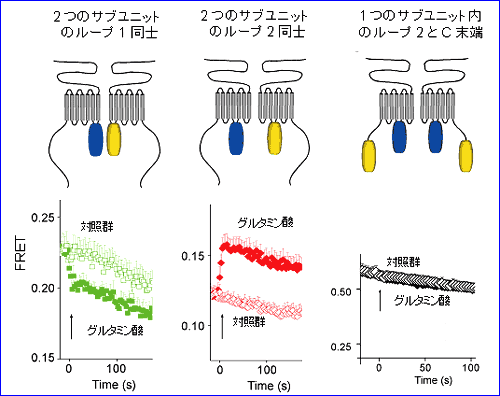
異色の蛍光物質間で、距離が近いほど、エネルギーの受け渡し(FRET (Fluorescent Resonance Energy Transfer) 効率)が大きくなることが物理化学的に知られている。我々は、mGluR1 のリガンド投与による構造変化を、FRET 効率の変化として捉えることを計画した(図 1)。まず、遺伝子工学的に、mGluR1 の細胞内領域の様々な箇所に、シアン色の蛍光蛋白CFP、もしくは黄色の蛍光蛋白YFP、もしくはその両方を付加し、この分子をHEK293細胞に発現させた。一般的に、膜蛋白ではあっても、細胞に強制発現させた場合、膜上に存在するばかりでなく細胞内に貯留する。我々の目的は、リガンド投与に伴うFRET の変化を測定することなので、細胞内に貯留する分子の放つ蛍光は、変化分を薄めてしまうバックグラウンドとなる。当初、この点について考慮しないまま行っていた、通常の光学システムにより細胞全体から発せられる蛍光を測光していた実験では、信頼できる FRET 効率の変化は検出できなかった。そこで、次のステップとして、エバネセントフィールド顕微鏡を導入して、全反射時に漏れ出るいわゆるエバネセント光により細胞膜上に存在する分子のみを照明し発する蛍光を測光することにした。リガンド投与に伴う FRET 効率の変化を解析したところ、以下の知見が得られた(図 2)4)。
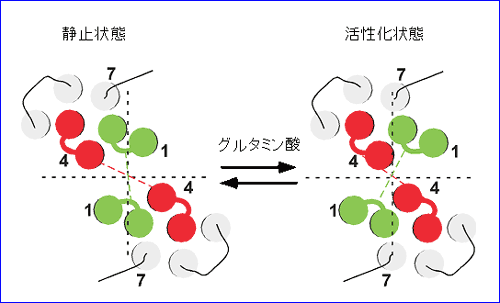
(1) 細胞内ループ1 に CFP もしくは YFP を付加したコンストラクトを用いた実験では、グルタミン酸投与により、FRET 値が下がる。すなわち、受容体活性化に伴い、2 量体サブユニットの細胞内ループ 1 は相互に遠ざかる。 (2) 細胞内ループ2 に CFP もしくは YFP を付加したコンストラクトを用いた実験では、グルタミン酸投与により、FRET 値が上がる。すなわち、受容体活性化に伴い、2 量体サブユニットの細胞内ループ 2 は相互に近づく。 (3) ひとつのサブユニットの細胞内ループ2 と C 端細胞内領域にそれぞれ CFP と YFP を付加したコンストラクトを用いた実験では、グルタミン酸投与により、FRET 値は変化しない。すなわち、受容体活性化に伴い、ひとつのサブユニットの内部では明らかな構造変化は起こらない。 これらの知見から、リガンド投与により mGluR1 の細胞内領域においては、個々のサブユニットの構造が変化するというよりは、2 つのサブユニット間の配置がずれ、回転等を伴って変化することが示唆され(図 3)、この動きがG蛋白質の活性化を引き起こすと考えられた4)。
さらに、ループ2 に CFP/YFP を付加したコンストラクトをもちいて、アゴニストである DHPG の作用を見たところ、グルタミン酸の場合と同様な変化を示した。また、FRET 変化 / グルタミン酸濃度のプロットが、競合的アンタゴニスト (s)-MCPG によっては右側にシフトし、非競合的アンタゴニスト CPCCOEt によっては、下側に下がる。という結果が得られた。これらの結果は、我々が測定している FRET 効率の変化が、受容体の機能を反映するものであることを裏付けると共に、CFP/YFP 付加 mGluR1 が比較的正常な蛋白質構造を保っていることを示している。 ところで、我々は以前、下流の反応を指標として、グルタミン酸のみならずCa2+、Gd3+などの細胞外多価陽イオンによってもmGluR1 が活性化されることを発表した5)。その後、Gd3+ の結合部位が、結晶構造解析によって、グルタミン酸結合部位や、我々の同定したCa2+ 感受性の決定に重要な部位5) とは異なる、2つのサブユニット間の負電荷を持つアミノ酸に富む領域に明確に同定された6)。我々は、この部位が機能的に重要であることを、点変異体の解析により明らかにした7)。今回、ループ2 のコンストラクトにより、細胞外のCa2+ や Gd3+ が mGluR1 の構造変化を確かに引き起こすことが確認された4)。Gd3+ は、脳脊髄液中に存在しないが、これらの結果を考えあわせると、Gd3+ の作用を模倣する生理的物質が脳に存在している可能性を示唆しているようにも思われる。 ゲノムプロジェクトが完了し、今後は、ゲノムのコードする個々の蛋白の構造と機能を解析していくことが求められている。そのため、蛋白の結晶を用いて行う、いわゆる構造解析が精力的に進められているが、膜機能蛋白の場合は結晶化が容易でないため一般に極めて困難である。また、結晶化した構造を知るだけでは、動態に関する情報が欠如しているため、リアルタイムで、生きた細胞における膜機能蛋白の動的構造変化を解析する研究手法が切望されてきた。FRET 法による水溶液中の蛋白構造変化の解析は、既に確立されているが、生細胞で受容体蛋白に適用し成功した例は、極めて少ない。我々の研究は 「生細胞における膜機能蛋白分子の動的構造変化のリアルタイム測定」 を確立した点において意義があると考えている。ポストゲノムの時代に、蛋白の構造と作動原理を探っていくために、構造生物学的アプローチを相補うものとして、大きな期待が持てるからである。 文献 |