小Maf群因子を含む2量体は,赤血球膜形成,血小板形成,神経細胞の機能維持,酸化ストレス応答・異物代謝機構,など様々な生命現象を制御している.小Maf群因子それ自身は,転写活性化領域を持たず,様々な機能ドメインを有するCNC・Bach群因子をDNAに結合させるための陰役者であるようにみえる.しかし,マウス発生工学を駆使して作製された遺伝子操作マウスを用いた最近の研究から,小Maf群因子が,実は,こうした2量体による転写制御機構を根本で調節する重要な分子であることが明らかにされつつある.本稿では,これまでの研究の歴史に触れながら,分子レベルから個体レベルに至る包括的な解析により明らかにされてきた,生体における小Maf群因子の機能について,筆者らの研究成果を中心に概説する.はじめに 小Maf群因子は塩基性領域ムロイシンジッパー(bZip)構造を有するDNA結合蛋白質である.1989年,西澤らによりトリレトロウイルスから癌遺伝子v-mafが発見され,次いで,その細胞性因子c-mafが同定された.その関連因子として,大Maf群因子と小Maf群因子が報告され,小Maf群因子としては,これまでにMafG, MafK, MafFの3種類が同定されている.また,近年急速に情報が蓄積しているデータベースの情報によれば,Maf群因子は,ヒトから魚類にいたる脊椎動物で非常に良く保存されていることがわかる.また,ショウジョウバエにおいても小Maf群因子の相同分子が存在することが報告されている8).大Maf群因子が,そのアミノ末端領域に転写活性化領域を持ち,転写活性化能とそれに相関した形質転換能を有するのに対して,小Maf群因子はそのほとんどがbZip構造であり,転写活性化領域は有していない.このため,当初は,小Maf群因子は,大Maf群因子に対して競合的に拮抗する抑制性因子であると予想された.しかしながら,1993年のAndrewsらによるNF-E2 p45の発見と, 1994年の五十嵐らによる小Maf群因子の再発見が,小Maf群因子の支える生命現象を解き明かす端緒を与えることになる.
1.Small Maf Biologyの黎明期 1)Maf群因子の認識配列と構造
Maf群因子はホモ2量体を形成してDNAに結合する.その認識配列は,TGCTGA(G or C)TCAGCAまたはTGCTGA(GC or CG)TCAGCAという13塩基あるいは14塩基の回文配列である(Maf群因子認識配列 Maf recognition element; MARE,図)
 . .
この配列は,おもしろいことに,c-Jun/c-Fosのヘテロ2量体からなるAP-1の結合配列TPA-responsive element (TRE; TGA(G or C)TCA),あるいは,CREB/ATFの結合配列であるcAMP-responsive element(CRE; TGA(GC or CG)TCA)を中心に包含しつつ,その外側にTGC---GCAという3塩基ずつの配列を持つ.TREあるいはCREの部分を含むMAREを,それぞれT-MARE,C-MAREと呼び,TRE,CREの部分をcore配列,その両側の部分をflanking配列と呼ぶ.Maf群因子は, flanking配列を持たないTREもしくはCREに対して,高い親和性で結合することはできない.つまり,強い結合のためにはflanking配列を要求するということが,Maf群因子の大きな特徴である.
Maf群因子には,そのbZip構造のアミノ末端側に,全てのMaf群因子において非常に良く保存された配列が存在する.この配列は,Extended Homology Region(EHR),あるいは,Ancillary DNA Binding Region12)と呼称されており,Maf群因子の基本的機能に関与していることが予想されていた.また,様々なbZip型転写因子のDNA 結合領域である塩基性領域を比べてみると,Maf群因子でのみ,特徴的なアミノ酸配列が存在していることがわかる(図).
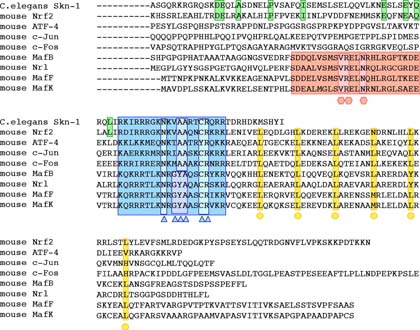
構造生物学的な解析から,EHRの存在と特徴的な塩基性領域という分子の構造が,Maf群因子特有の認識配列を規定しているということが明らかになった.筆者らは小Maf群因子MafGのDNA結合領域であるEHRと塩基性領域の構造をNMRにより解析し,それが,3つのヘリックスからなっていること,EHRがflanking配列の要求性を担っており,とりわけ,3つのアミノ酸(V34, R35, N38)が重要であることを明らかにした(図2,図3).また,Kerppolaらは,塩基性領域の特徴的アミノ酸配列がflanking配列の認識に重要であることを示した.このように,Maf群因子は,これまで知られていたbZip型転写因子とは異なる新規のDNA認識様式をとるものと考えられる.
Maf群因子は,アミノ末端側に転写活性化領域を持つ大Maf群因子と,持たない小Maf群因子とに分けられる.小Maf群因子には,ヒト,マウス,トリにおいてMafG, MafK, MafFの3種類が報告されている.これらはほぼ同じ構造をとっているが,MafGだけC末端領域に14アミノ酸の挿入があり,他の2つよりも長い構造をとっている.しかし,その機能はまだ不明である. RNAブロットや定量的RT-PCRによりこれらの発現を調べると,様々な組織において,3つの小Maf群因子は重複して幅広く発現している.一方,大Maf群因子には,c-Maf, MafB, NRL, L-Mafの4種類が報告されている.大Maf群因子は,小Maf群因子と異なり非常に限局した細胞系列にのみ発現が認められる.例えば,マウスのc-Mafはレンズの繊維細胞に発現しているが,MafBはレンズ上皮細胞に発現している.
2)赤血球特異的転写因子NF-E2の小サブユニットとしての小Maf群因子
生体における小Maf群因子の機能解析は,赤血球特異的な転写制御研究における一つの発見をきっかけに,大きく進展することになった.グロビン遺伝子や,ヘム合成系酵素遺伝子などの赤血球特異的遺伝子の転写制御研究から,組織特異性を規定する重要な制御エレメントとして,GATA配列,CACC配列などに加えて,TRE様配列(TGCTGAGTCAT)が同定された22~24). TRE様配列に対する結合活性は,赤血球系細胞特異的に存在することから,nuclear factor-erythroid 2 (NF-E2)と呼ばれ,同配列はNF-E2結合配列と呼ばれた25).赤血球特異的転写活性化を指令するNF-E2結合配列の機能には,TREコア配列の外側に存在するGCの2塩基が非常に重要であるため,NF-E2の実体は, TREの外側に特定の塩基配列を要求しないJunやFosとは異なる新規因子であることが予想された. Andrewsらは, MEL細胞の核抽出液から,NF-E2結合配列に結合する蛋白質を精製し,新規bZip型転写因子NF-E2 p45を同定した.これは,ショウジョウバエで同定されていたcapユn collar (cnc)のマウスにおける相同分子であった.しかし,NF-E2 p45のみでは,NF-E2結合配列への結合が認められず,第2の因子の必要性が推測された.
TRE配列の外側にGCの2塩基が必須だというNF-E2結合配列の特徴は,まさにMAREの特徴と一致するものである.五十嵐らはこの点に着目して,小Maf群因子がNF-E2 p45とヘテロ2量体を形成してNF-E2結合配列を介した転写活性化を指令できることを示した.Andrewsらが,p45とともに精製されてくる18 kDaの因子のアミノ酸配列を決めたところ,やはり,それは小Maf群因子MafKであった26).小Maf群因子がNF-E2のサブユニットとして機能するということは,同因子が他のbZip転写因子のヘテロ2量体形成相手分子として機能する可能性を示したという点において,小Maf群因子の再発見というべき結果である.
2.小Maf群因子の発現量と機能
1)小Maf群因子の冗長性
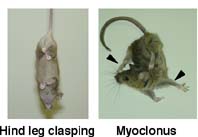
生体における小Maf群因子の機能を明らかにするために,筆者らは3つの小Maf群因子の遺伝子破壊マウスを作製し,それぞれの表現型を調べた.mafK欠損マウスとmafF欠損マウスでは,目立った異常は検出されなかった.mafG欠損マウスでは,末梢血の血小板が半分程度に減少し,hind leg claspingと呼ばれる軽度の運動異常が認められた(図).
相互の複合変異マウスを作製すると,mafK::mafF2重欠損マウスには特に異常はなく,mafF::mafG2重欠損マウスは,ほぼmafG単独欠損マウスと同様の表現型であった.
興味深いのは,mafG::mafK複合変異マウスの表現型で, mafG単独欠損マウスの表現型が重篤化するとともに,新たな表現型が出現した29).mafG::mafK2重欠損マウス (mafG-/-::mafK-/-)は,生後2−3週で致死であり,赤血球膜の異常をともなった貧血を呈する.これらは,MafKとMafGが同時に欠損することにより顕在化した新たな表現型である.赤血球膜の蛋白質構成に異常が生じており,赤血球の形態異常が認められた(図).
また,血小板がほとんど形成されず,出血傾向が顕著で,生後2週目以降から間欠的な四肢の強直 (myoclonus) という重篤な運動障害が認められる(図).
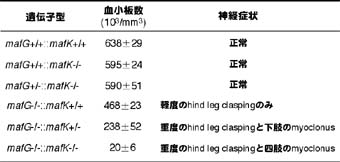
これらは,mafG単独欠損マウスの表現型が重篤化したものと理解される.血小板減少と神経症状は,mafG欠損状態における野生型mafK遺伝子の数が少ないほど重篤である(図).これらの結果から, MafKとMafGは相補的に機能しているといえる.巨核球と神経組織においては,MafKよりMafGの貢献が大きいと考えられるが,これは,両分子の質的な相違による,あるいは,発現量の違いによるという2つの可能性がある.これら2つの細胞系列・組織では,MafKよりMafGの発現量が遙かに多いことから,後者の解釈が適当と考えられる(後述参照).
MafFの生体における貢献については,小Maf群因子2重欠損マウスの作製によっても依然判断ができない.そこで,小Maf群因子の完全欠損マウス,3重遺伝子欠損マウスを作製したところ,同変異マウスは胎生中期で致死であった(投稿準備中).この結果は,mafF遺伝子の必要性を初めて示すものである.また,mafG-/-::mafK+/-マウスは,重度の神経症状と血小板減少を呈するものの,その寿命は野生型マウスと変わらないが,mafG-/-::mafK+/-::mafF-/-マウスは生後3週前後で死亡する.この結果は,mafFが胎生期のみならず,生後も機能的分子であることを示している.
2)小Maf群因子の発現量と機能
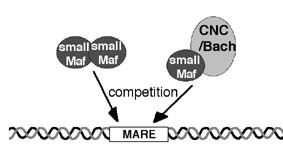
p45の発見以降,その関連因子として, Nrf1, Nrf2, Nrf3が同定され,これらがCNC群因子ファミリーを形成していることが明らかになった.また,MafKに相互作用する因子として,Bach1, Bach2が同定された.これらは,単独でDNAに結合することはできず,転写因子としての機能を発揮するには,小Maf群因子と2量体を形成しなくてはならない.CNCあるいはBach群因子には,転写活性化や抑制化,あるいは,蛋白質相互作用を担う機能ドメインが存在するのに対して,小Maf群因子はほとんどがEHR-bZip構造からなっている.したがって,小Maf群因子は,ヘテロ2量体を形成しているときには,その相手分子の機能発現を支持し,一方,ホモ2量体を形成してMAREに結合しているときには,CNCやBach群因子による作用を競合的に阻害することが想定される(図).
培養細胞に対する一過性遺伝子導入実験で,p45とMafKを様々な割合で発現させた場合,ある割合において,MARE依存的な転写活性化が最大となることが示されている.つまり,小Maf群因子は,その存在量により2量体形成相手分子であるCNCあるいはBach群因子の作用をオン・オフと変化させるスイッチ分子である可能性が示唆されていた.筆者らは,このモデルが生体において成立し得るものかどうか,遺伝子改変マウスを用いた実験により検証を試みた.
mafG欠損マウスやmafG::mafK2重欠損マウスでは,血小板数の減少が認められ,巨核球から血小板が形成される主な経路と考えられる胞体突起形成が障害されている29)(図).
つまり,小Maf群因子の減少により,巨核球の最終分化段階が障害されているといえる.これは,CNC群因子の1つであるNF-E2 p45の遺伝子破壊マウスにおける表現型と一致するものである.巨核球からの核抽出液を調製してゲルシフト実験を行うと,検出可能なMAREに対する結合活性は, NF-E2 p45/小Maf群因子からなるヘテロ2量体であった.これらの結果は,胞体突起形成には,NF-E2 p45/小Maf群因子ヘテロ2量体の機能が必須であることを示している.
次に,胞体突起形成をパラメーターとして,同ヘテロ2量体の機能を生体内において評価することを試みた. GATA-1遺伝子の制御領域を利用して,赤血球・巨核球系細胞特異的に小Maf群因子を発現するトランスジェニックマウスを作製し,その巨核球を調べた37).面白いことに,小Maf群因子過剰発現マウス由来の巨核球でも,小Maf群因子欠損マウスと同様に,胞体突起形成が抑制されており,小Maf群因子の発現量が多いものほど,胞体突起形成の抑制が顕著であった(図).
つまり,小Maf群因子の量が不足しても過剰でも胞体突起形成は抑制されることが示された.mafG欠損マウスと小Maf群因子過剰発現マウスを交配して,骨髄における小Maf群因子の発現量を野生型のものと同レベルに戻すと,期待通り,胞体突起形成の頻度は正常化した(図). NF-E2 p45の標的遺伝子であるトロンボキサン合成酵素遺伝子38, 39)の発現量と,胞体突起形成の頻度の間には,正の相関が認められた.この結果は,巨核球において,小Maf群因子の量的変動が,MAREを介する転写の正負両方向の制御を指令できることを意味しており,個体における小Maf群因子のスイッチ分子としての可能性を示すものである(図).
一つ注目すべきこととして,mafG変異マウスの胞体突起形成障害は,MafK過剰発現マウスとの交配によってもレスキューされることから,MafGとMafK分子の間に明らかな質的相違はないものと考えられる.したがって,mafK欠損マウスは正常で,mafG欠損マウスでのみ胞体突起形成障害が認められるのは,巨核球でのMafGの発現量がMafKのそれに比べて非常に多いという,発現量の違いによると理解できる.
3.複数のbZip型転写因子による転写制御システム
1)生体における真の機能分子は?
MAREには,小Maf群因子ホモ2量体やNF-E2 p45/小Maf群因子ヘテロ2量体などの小Maf群因子を含む2量体の他に,大Maf群因子2量体やJun, Fosも結合することができ, MAREに対する結合をめぐって,複数の2量体が競合する可能性が示唆される7).それと同時に,2量体を形成するbZip型転写因子には,いろいろな組み合わせが可能であり,2量体形成相手分子をめぐる競合も生じる可能性がある.転写因子をシグナル伝達系の最終的なエフェクターと捉えるならば, MAREを介する転写制御は,様々なシグナル伝達系のクロストークの場であり,情報統合のステップであると理解できる.
ここで重要な問題は,理論上想定可能である様々な2量体のうち,特定の生命現象において最も貢献度が大きいものをいかに見極めるかということである.この際,非常に強力な手段となるのは,遺伝子破壊マウスの作製による個体レベルでのloss of function実験である.2つの因子が,生体において時間的・空間的に共存し,それら因子をコードする遺伝子それぞれのノックアウトマウスが,互いに共通する表現型を示すならば,それは,これらの因子が生体内で実際に協調的に機能しているということの非常に強力な証拠となる.
NF-E2 p45とMafGは,いずれも巨核球に発現しており,その核抽出液中のMAREに対する結合活性は,ほとんどがNF-E2 p45/MafGヘテロ2量体で構成されており,さらに,それぞれの遺伝子破壊マウスでは,共通して巨核球からの胞体突起形成が障害されている.こうした生化学的・遺伝学的な根拠の集積により,同ヘテロ2量体が巨核球の最終分化段階において真に機能的であると結論される.
HO-1遺伝子の制御におけるBach1と小Maf群因子の関与も,同様のアプローチにより個体レベルで証明されている.Bach1もMafG, MafKいずれも神経組織に発現しており,神経組織から調製した核抽出液にはBach/小Maf群因子ヘテロ2量体のMARE結合活性が検出される.bach1遺伝子破壊マウスでも, mafG-/-::mafK+/-マウスでも,神経組織におけるHO-1遺伝子の発現が異常に亢進しており,通常, Bach1/MafG or MafKヘテロ2量体がHO-1遺伝子を抑制していることが個体レベルで示された.
2)赤血球系細胞におけるNF-E2の実体
CNC群因子として最初に同定されたNF-E2 p45は,先述の通り,赤血球特異的な転写に重要な転写因子として同定された.MEL細胞は,DMSOにより赤血球系遺伝子の発現が誘導され,ヘモグロビンを産生するようになるが,NF-E2 p45を欠損するMEL細胞亜株CB3細胞は,このような分化形質を示さない.この細胞に対してNF-E2 p45を外来性に導入して発現させると,DMSOに反応して分化形質を発現するようになる.また,K562細胞,あるいは,MEL細胞を用いたクロマチン免疫沈降実験で,NF-E2 p45が,細胞内でグロビン遺伝子の制御領域に結合していることが示されている.こうした結果から,NF-E2 p45は,赤血球系細胞の分化に必須の因子であることが予想されていた.
しかし,NF-E2 p45の遺伝子破壊マウスは,意外にも,赤血球形成には異常がなく,血小板がほとんど形成されないという結果であった.これは,赤血球系細胞におけるNF-E2 p45の機能が,別のbZip型転写因子により代償されているためと考えられる.その有力候補としてNrf1とNrf2が単離されたが,いずれの遺伝子破壊マウスにおいても,細胞自立的な赤血球細胞の異常は認められていない.nrf1遺伝子破壊マウスでは,胎生後期に貧血が認められるが,これは,nrf1ホモ欠損ES細胞を用いたキメラ実験から,細胞自立的なものではないことが示された.Nrf2がNF-E2 p45の機能を代償している可能性が疑われ,NF-E2 p45::nrf22重欠損マウスが作製されたが,赤血球系細胞の異常は認められなかった.一方,NF-E2の小サブユニットと考えられている小Maf群因子についても, in vivoでのその役割を決定的に支持する結果は未だ得られていない.つまり,小Maf群因子の単独欠損・2重欠損マウスいずれにおいても,グロビン遺伝子の転写は正常である.この結論は,小Maf群因子の完全欠損状態である3重欠損マウスの解析を待たなくてはならない.個体において赤血球系細胞のMARE結合活性を担う実体は,今後解明されなくてはならない課題である.
3)異物代謝・酸化ストレス応答機構への小Maf群因子の貢献
Nrf2は,とりわけ転写活性化能の強い転写因子であり,異物や酸化ストレスに対する生体防御の鍵となる因子である.生体が異物に曝露されると,まず第1相反応として,チトクロームp450系酵素群による異物の酸化,あるいは,水酸化反応がおこる.反応性に富む代謝中間体は,引き続き,第2相反応として,グルタチオンや硫酸基などによる抱合を受けて体外に排出される.抱合反応を触媒するのが,異物代謝系第2相酵素群である.異物代謝系第2相酵素群は第1相反応で生じる親電子性中間体の刺激により,酸化ストレス応答蛋白質群遺伝子は酸化ストレスの刺激により,転写レベルで発現が誘導される53).nrf2欠損マウスでは,こうした誘導的発現が認められないことから,Nrf2がこれらの遺伝子発現を統一的に制御していることが明らかになった50).第2相酵素群や酸化ストレス応答蛋白質の遺伝子発現制御機構の解析から,これら遺伝子の誘導的転写活性化には,antioxidant responsive element (ARE)54)あるいは,electrophile responsive element (EpRE)55) と呼ばれるMAREに類似したシスエレメントが重要であることが報告されており, Nrf2は実質的なARE結合因子であったといえる.
Nrf2の強力な転写活性化を支える2量体形成相手分子については,これまで様々な議論がなされている.AREの配列の特徴であるモGCモの要求性が,小Maf群因子のDNA認識様式の特徴であるflanking配列の要求性と一致することから,筆者らは小Maf群因子がNrf2の相手分子であると予想してきた.一方で,培養細胞に対してNrf2と小Maf群因子を一過性に過剰発現させた場合,協調的な転写活性化がなかなか観察されないことから,Nrf2の転写活性化に寄与する相手分子は別に存在するのではないかという可能性が疑われ,c-JunあるいはATF4といった因子が候補として提唱されている.この問題については,現在2つの方向から個体レベルでの解析が進行中である.
一つは,小Maf群因子欠損マウスで,nrf2欠損マウスと同様に,第2相酵素群や酸化ストレス応答蛋白質の誘導が障害されているかどうかという点の検討である.もう一つは,Nrf2の抑制性因子Keap1の欠損によりもたらされるNrf2の恒常的活性化が,小Maf群因子を要求するかどうかという点の検討である(図).
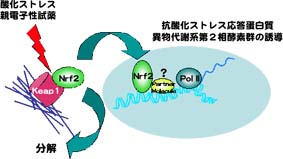
keap1遺伝子欠損マウスは離乳前後で死亡するが,この致死性は,keap1::nrf22重欠損マウスでは完全にレスキューされることから,Nrf2の恒常的活性化に依存していることがわかる.したがって,keap1遺伝子欠損マウスの表現型が,keap1::小Maf群因子複合変異マウスにすることにより,改善するかという遺伝学的手法が可能である.
|


