
 |
低酸素環境応答の分子メカニズム −赤血球増殖因子エリスロポエチンの産生制御機構解析− |
||||
|
哺乳類にとって、酸素は細胞機能の存続に必要なエネルギー源であるため、酸素の欠乏は生命に関わる重要な問題となります。生体が低酸素状態になる原因としては、貧血や心肺機能の異常、高地生活などがありますが、このとき、生体内の各細胞は様々な遺伝子の発現様式を変化させることにより、低酸素環境に適応しようとします。例えば、体内に酸素を運搬する赤血球を増加させたり、新たに血管を形成したりして、少ない酸素を効率よく利用できるようになります。 エリスロポエチン(Epo)は赤血球産生に必要な造血ホルモンであり、貧血時や低酸素環境(高地など)への曝露により、Epoの腎臓からの分泌量が著しく亢進します。本研究では、低酸素ストレスに対する生体応答の分子メカニズムを明らかにするために、Epoの産生調節機構とその作用機序に着目し、遺伝子改変マウスを利用した研究を進めています。マウス個体を用いた解析を通して、実際に生体内で機能する応答メカニズムを明らかにするとともに、医療や福祉に役立つ研究成果を得ることを目標としております。
|
|||||
|
Epo の造血作用と造血外作用 |
|||||
|
Epoは非常に高い赤血球産生促進作用を有しています。実際に、世界初の遺伝子組換え製剤として、貧血の治療に活用されており、分子生物学研究が医療に有効であることを示した金字塔となっています。その一方で、持久性スポーツ選手が自身の赤血球を増加させ、持久力(酸素運搬能力)を高めるためにドーピング利用しており、問題となっています。赤血球が増え過ぎると、血栓の原因となり、心筋梗塞や脳梗塞を引き起す危険があることから、WADA(世界アンチドーピング機構)の禁止薬物にも指定されています。 |
|||||
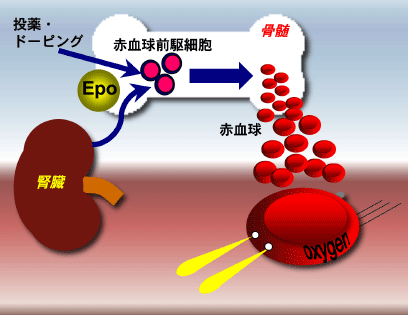 |
[図1]体内で低酸素状態が感知されると、腎臓でのEpo産生と分泌が誘導される。その結果、Epoは骨髄中の赤血球前駆細胞に分化・増殖を促すため、体内の赤血球数が亢進し、酸素供給能が高くなる。赤血球は肺で得た酸素を全身に配る運び屋である。一方、Epo製剤の開発により、貧血治療やドーピングでは、 Epoの注射によって赤血球数を増加させることもできるようになった。 |
||||
|
Epoは腎臓で産生された後、血流を介して骨髄に到達します。ここでEpoは赤血球前駆細胞上に存在するEpo受容体と結合することにより、赤血球増産のシグナルを伝えます。近年、Epo受容体が非造血細胞でも発現していることが明らかとなり、Epoには造血以外にも作用があるのではないかと考えられるようになりました。特に、神経や心筋の保護に有効であると期待され、盛んに研究が進められています。 |
|||||
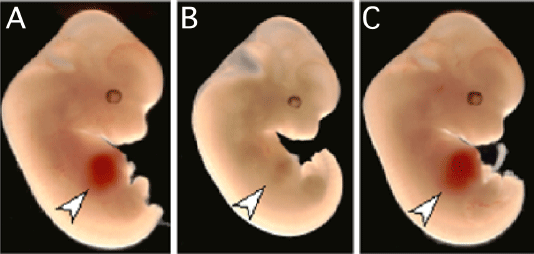 |
[図2]Epo受容体欠損マウスの胎児(B)は、貧血であり、肝臓(矢印)が白く見える。Epo受容体欠損マウスは生まれることができないが、このマウスの赤血球系細胞でのみEpo受容体を発現させると、貧血が改善され、正常に発育した(C)。(A)は正常マウスの胎児。 |
||||
|
Epoの造血外作用を明らかにするためには、モデルマウスの開発が必要でした。そこで、私たちの研究グループでは、マウスの遺伝子改変技術を駆使して、血球以外の細胞ではEpo受容体を発現しないマウスの樹立に成功しました(文献1)。Epo受容体を完全に欠損したマウスは、赤血球を作ることができず、胎生13日ころに全例死亡します(図2)。しかし、今回作成したマウス(レスキューマウス)は、赤血球ではEpo受容体を発現しているため、貧血にはならず、正常に生まれました(図2)。この結果は、Epoがマウスの発生や生存、繁殖に必須ではないことを示しております。現在、国内外の研究グループとレスキューマウスを利用した共同研究を進めており、Epoの神経系や心血管系での作用についての研究を行っております(文献2、3)。 |
|||||
|
*当マウスにご興味のある方はご連絡ください。理研BRCより分与可能です。http://www2.brc.riken.jp/lab/animal/detail.cgi?reg_no=00985 |
|||||
|
|
|||||
|
|
|||||
|
Epoの産生機序 |
|||||
|
Epo遺伝子は、生体への低酸素負荷に応じて、腎臓および肝臓で顕著に誘導されるという特徴があります。持久性スポーツ選手が高地トレーニングを行う理由は、酸素分圧の低い高地でのトレーニングにより、Epo遺伝子をはじめとした様々な遺伝子発現を誘導し、各組織への酸素供給効率を高めるためです(図3)。 |
|||||
 |
|||||
|
[図3]研究者自身のREP細胞にもEpo発現刺激を与えるために、年に1度は高地へ赴く。→山本研登山部のページへ
|
|||||
|
遺伝子の転写反応は、個体発生や細胞分化に伴って予めプログラムされた「組織特異的制御」と生体周囲の環境変化に応じて変化する「誘導的制御」の2大要素によって調節されています(文献4)。したがって、Epo遺伝子は、転写制御の2大要素を統合的に研究する上で、非常に優れたモデル遺伝子であると考え、個体レベルでのEpo遺伝子発現制御機構の解析に取り組んでいます(図4)。 |
|||||
|
|
|||||
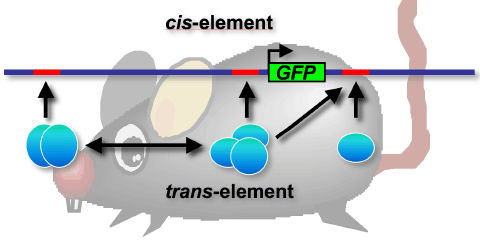
| [図4]BAC-GFPトランスジーンを用いたEpo遺伝子発現制御機構の解析。 Epo遺伝子発現は、 Epo遺伝子近傍のcis-element(DNA)とtrans-element(タンパク質)との複雑な相互作用により、組織特異的および低酸素誘導的に調節されていると考えられる。本研究では、約200 kbにおよぶ巨大DNAとGFP遺伝子を利用し、Epo遺伝子のcis-element同定に挑んでいる。トランスジーンがEpo遺伝子の重要なcis-elementを含んでいた場合、トランスジェニックマウスはGFPを発現し、緑色蛍光が観察される。 |
|||||
 |
|||||
|
遺伝子制御機構の解析を進めるには、まず、その遺伝子の発現様式を知る必要があります。Epoが腎臓で産生されることは、腎不全によりEpo依存性の貧血になることからも明らかですが、腎臓のどの細胞がEpoを作っているのかについては、様々な説があり、よく分かっていませんでした。そこで、まず腎Epo産生細胞(REP細胞)の同定に取り組みました。 本研究では、レポータートランスジェニックマウスを用いたEpo産生細胞の同定を計画しました。これまでの研究により、個体で機能するEpo遺伝子発現制御領域は、20 kb以上の長い領域に及ぶことが示されていたことから、BAC(Bacterial Artificial Chromosome)を利用した約200 kbにおよぶ長い制御領域を扱った解析方法を導入しました。Epo遺伝子近傍の約180 kbの制御領域下でGFP(緑色蛍光タンパク質)を発現するようなレポータートランスジーンを構築し、マウスの染色体中に導入しました。この巨大トランスジーンは、貧血時の腎臓および肝臓特異的に発現し、組織特異的制御と誘導的制御に関与する制御配列を含んでいることが示されました。このトランスジーンの発現様式は内在性のEpo発現と同様であり、腎臓においては、尿細管間質の非常に小さな細胞で発現することがわかりました。GFPによりラベルされたREP細胞は、共焦点顕微鏡により3D観察され、世界ではじめて、Epo産生細胞の実態を捉えることに成功しました(図5)。この細胞については、更なる解析を進めております。 |
|||||
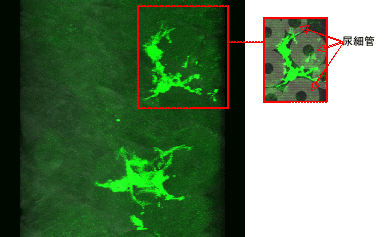 |
[図5]腎臓Epo産生(Renal Epo-Producing:REP)細胞の3Dイメージ(動画)。BAC-GFPトランスジェニックマウスに貧血を誘導し、腎臓の凍結切片を共焦点顕微鏡で観察した。REP細胞は尿細管の間に存在し、細い突起をいくつも伸ばしていることがわかった。 |
||||
|
現在、Epo遺伝子の組織特異的制御と誘導的制御に関与する制御配列を同定するため、この巨大トランスジーンの分子解剖を行い、詳細な解析を行なっています。重要であることが実験的に示された制御配列については、ノックアウトマウス作成方法を応用し、制御配列欠損マウスを樹立しています。これにより、制御配列の生理的な機能についても明らかにすることができます(図5)。 |
|||||
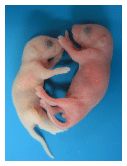 |
[図6]肝臓でのEpo遺伝子発現に重要な役割を果たすことが示された制御配列について、その配列を欠失したマウスを樹立した。その結果、マウスは貧血を発症し、青白い新生児(左)が出生した。この結果から、肝臓でのEpo産生の重要性が示された。右は正常マウスの新生児。 | ||||
|
文献 1. Erythroid-specific expression of the erythropoietin receptor rescued its null mutant mice from lethality. Suzuki N, Ohneda O, Takahashi S, Higuchi M, Mukai YM, Nakahata T, Imagawa S, Yamamoto M. Blood. 2002 Oct 1;100(7):2279-88 2. HLF/HIF-2alpha is a key factor in retinopathy of prematurity in association with erythropoietin. Morita M, Ohneda O, Yamashita T, Takahashi S, Suzuki N, Nakajima O, Kawauchi S, Ema M, Shibahara S, Udono T, Tomita K, Tamai M, Sogawa K, Yamamoto M, Fujii-Kuriyama Y. EMBO J. 2003 Mar 3;22(5):1134-1146. 3. Important role of endogenous erythropoietin system in recruitment of endothelial progenitor cells in hypoxia-induced pulmonary hypertension in mice. Satoh K, Kagaya Y, Nakano M, Ito Y, Ohta J, Tada H, Karibe A, Minegishi N, Suzuki N, Yamamoto M, Ono M, Watanabe J, Shirato K, Ishii N, Sugamura K, Shimokawa H. Circulation. 2006 Mar 21;113(11):1442-1450. 4. 単行本『キーワードで理解するシリーズ「転写イラストマップ」』(羊土社)「組織特異的遺伝子発現」p.139-149 小原 直、鈴木教郎、山本雅之 2004年10月30日発行 5. 単行本『エリスロポエチンのすべて』(メディカルレビュー社)「産生細胞と発現制御」 p.43-56 鈴木教郎、山本雅之 2005年11月1日発行 |
|||||