
 |
Keap1-Nrf2システムによる酸化ストレス・親電子性物質防御機構 |
|||
|
様々なメディアを通じて,非常に一般的になった酸化ストレス.最近の研究から,活性酸素種や食物に含まれる親電子性物質によりもたらされる酸化ストレスは,DNAやタンパク質,脂質などの生体高分子を酸化することで傷害を与えるため,ガンや糖尿病などの生活習慣病を引き起こす素因になると考えられています.一方,このような外来物質だけではなく,生体内に存在するプロスタグランジンJ2(PGJ2)などの生理活性物質もまた,内因性の親電子性物質として作用し,炎症の終焉に貢献します.すなわち,酸化ストレスは外来物質や代謝副生成物だけではなく,細胞内情報伝達におけるセカンドメッセンジャーとしても機能しているわけです.このような酸化ストレスに対し,細胞はすみやかに生体応答を発動することで,その恒常性維持と適応に努めています.この生体応答の制御機構において,重要な機能を担っているのが,Keap1-Nrf2システムです.私たちの研究室では,生化学・分子生物学的な解析とマウス発生工学的手法による個体レベルの解析,さらには構造生物学的なアプローチも取り入れて,多角的にKeap1-Nrf2システムによる分子レベルの制御機構とその生理機能を解明し,世界をリードし続けています. |
||||
|
Keap1-Nrf2システムによる酸化ストレス防御機構 |
||||
|
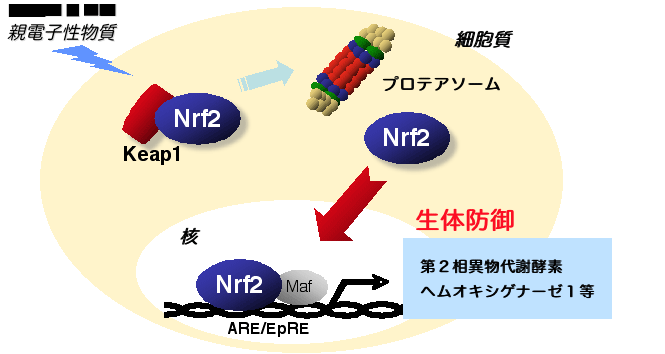
細胞が酸化ストレス・親電子性物質にさらされると,グルタチオン合成酵素やヘムオキシゲナーゼ1などの酸化ストレス応答遺伝子の発現誘導することで,生体防御に努めます(図1).この酸化ストレスによる遺伝子発現機構に関しては,遺伝子上流に存在する抗酸化剤応答配列ARE(antioxidant response element)または親電子性物質応答配列EpRE(electrophile responsive element)を介した転写レベルの発現調節が重要です.この制御配列には,塩基性ロイシンジッパー(bZip)型転写因子であるNrf2と小Maf群因子によるヘテロ二量体が結合し,遺伝子発現を強力に活性化します. 一方,非酸化ストレス下では,Nrf2はKeap1と名づけられた因子により細胞質に留められ核移行が阻害されることで,遺伝子発現が抑制されています.すなわちKeap1は,Nrf2の抑制性因子です.細胞に酸化ストレスないし親電子性物質がさらされると,Keap1によるNrf2抑制機構は解除され,核移行したNrf2が防御遺伝子の発現を誘導します.Keap1-Nrf2システムは,ストレス応答型の転写制御システムを形成しているのです. |
||||
 |
||||
|
図1 Keap1-Nrf2システム |
||||
|
Motohashi H. et al. (2004) Trends Mol. Med. 10: 549-557. Kobayashi M. et al. (2005) Antioxid. Redox. Signal. 7: 385-394. 伊東 健 (2004) 生化学 第76巻: 339-348. 伊東 健 (2006) 生化学 第78巻: 79-92. 勝岡史城 (2006) 細胞工学 第25巻: 153-156. |
||||
|
酸化ストレスセンサーKeap1 |
||||
| それでは,酸化ストレスはどのように感知され,転写因子Nrf2の活性化をもたらすのでしょうか?ここで,酸化ストレスセンサーとして機能するのがKeap1です(図2). Keap1は,624残基中25個のシステイン残基をもつ特徴的なタンパク質ですが,BTBドメインとIVRドメイン内に存在するシステイン残基(Cys151とCys273・Cys288)により酸化ストレスを感知していることを,MALDI-TOF質量分析法と培養細胞を用いた解析で明らかにしました.これらシステイン残基が,酸化ストレスにより修飾されることで,Keap1のダイナミックな構造変化をもたらし,後述するようなユビキチンライゲースとしてのKeap1の機能を抑制するのが,酸化ストレスによるNrf2活性化機構の一端ではないかと考えています | ||||
|
|
||||
|
図2 転写因子Nrf2と酸化ストレスセンサーKeap1 |
||||
|
Dinkova-Kostova A. et al. (2002) Proc. Natl. Acad. Sci. USA. 99: 11908-11913. Wakabayashi N. et al. (2004) Proc. Natl. Acad. Sci. USA. 101: 2040-2045. Kobayashi A. et al. (2006) Mol. Cell Biol. 26: 221-229. |
||||
| 2つの機能をもつKeap1 | ||||
|
ユビキチンライゲース アダプターとしての新たな機能 |
||||
|
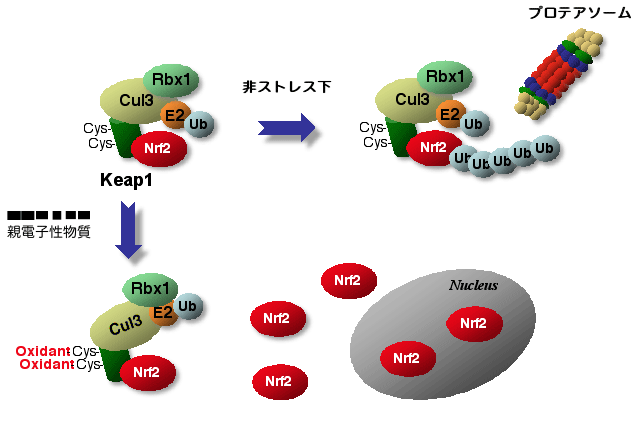
非酸化ストレス下では,Keap1により細胞質の留められた転写因子Nrf2は,さらにプロテアソーム依存的なタンパク質分解抑制を受けています.実際,マウス腹腔内マクロファージにおける内在性Nrf2のタンパク質寿命を測定すると,およそ18分と非常に不安定です.このNrf2分解機構のために,酸化ストレスのセンサーであるKeap1が,Cullin3 (Cul3)型ユビキチンE3ライゲースのアダプターとして機能し,Nrf2をユビキチン化することで,26Sプロテアソームにより分解していることを明らかにしました(図3).すなわち,Keap1は,酸化ストレスセンサーとユビキチンライゲースのアダプターという2つの機能を持つbifunctional proteinなのです.
|
||||
 |
||||
|
図3 Keap1は,ユビキチンライゲースアダプターとして機能する |
||||
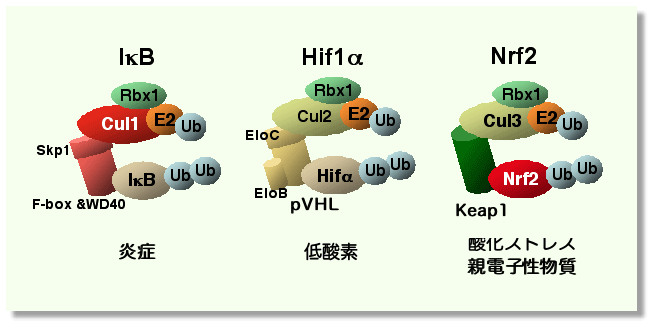
| ところで,Cul3と同じファミリーに属する Cul1とCul2は,それぞれ炎症,低酸素応答に関わるIkBとHif1aを,分解制御していることが知られています(図4).すなわち,Nrf2をはじめとするこれらのストレス応答因子は,Culファミリーによる分解抑制を受けており,その活性化機構はこの分解抑制からの脱抑制により担われている共通性に気づきます.タンパク質分解制御機構が,速やかなで,しなやかなストレス応答を可能にしているのでしょう. | ||||
 |
||||
|
図4 ストレス応答型因子の分解抑制機構の共通性 |
||||
|
Kobayashi A. et al. (2004) Mol. Cell Biol. 24:7130-7139. 小林 聡 (2006) 蛋白質核酸酵素増刊号 ユビキチンープロテアソーム系とオートファジー 印刷中 |
||||
|
Keap1によるNrf2認識機構 ー構造生物学的アプローチー |
||||
|
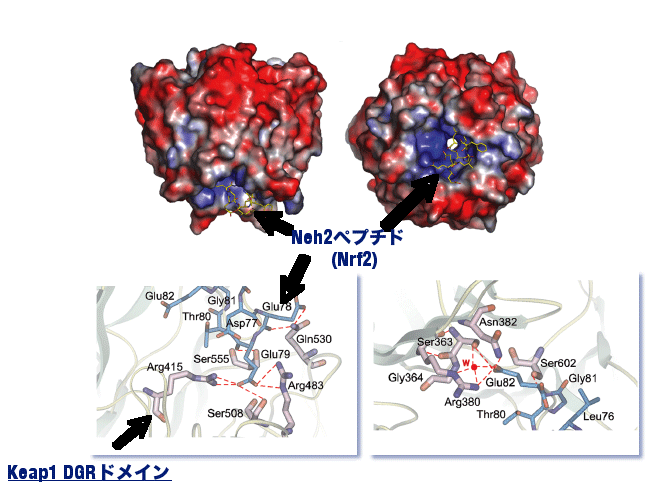
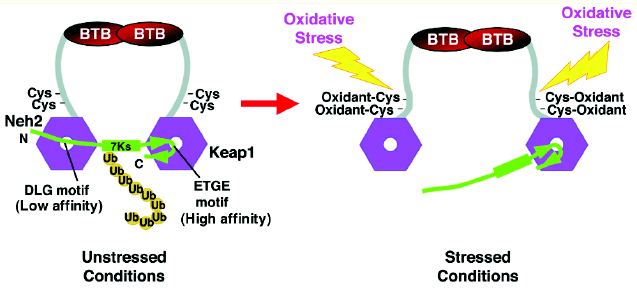
Keap1によるNrf2抑制機構では,Nrf2との相互作用がこの根幹を担っています.Keap1は,カルボキシ末端のDGR/Kelchドメインを介して,Nrf2のNeh2 (Nrf2-ECH homology)ドメインを認識します.最近私たちは,DGRドメインとNeh2ドメインの部分ペプチドからなる複合体のX線結晶構造解析に成功し,その分子認識機構に対して重要な知見を得ました(図5).DGRドメインは,b-バレル(あるいはプロペラ)構造とよばれる3次元構造をとり,そのドメイン中央の塩基性アミノ酸に富むポケットが,Nrf2のNeh2ドメイン内のETGEモチーフと静電的な相互作用をすることを明らかにしました. |
||||
 |
||||
|
図5 Nrf2部分ペプチドとKeap1 DGRドメインの複合体結晶構造 |
||||
|
一方,Keap1はアミノ末端にBTBドメインを有し,ホモ二量体を形成することが知られています.NMRと物理化学的解析により,Neh2ドメインのDLGモチーフも同様にDGRドメインのポケットと相互作用することがわかりました.以上の知見をもとに,私たちは図?にしめすようなKeap1-Nrf2複合体モデルを提唱しています(図6).このモデルでは,2つのDGRドメインが,DLGモチーフとETGEモチーフをつかむようにとらえます.この時,これらモチーフ間にユビキチン化されるリシン残基がならぶため,効率的なユビキチン基の転移が可能になると考えています. (X線結晶構造解析は,理化学研究所との共同研究です.) |
||||
 |
||||
|
図6 Keap1-Nrf2複合体モデル |
||||
|
Padmanabhan B. et al. (2006) Mol. Cell 21: 689-700. Tong KI et al. (2006) Mol. Cell Biol. 26: 2887-2900. |
||||
|
マウス個体を用いた酸化ストレスセンサーKeap1の機能解析 |
||||
|
1)Keap1ノックアウトマウス |
||||
|
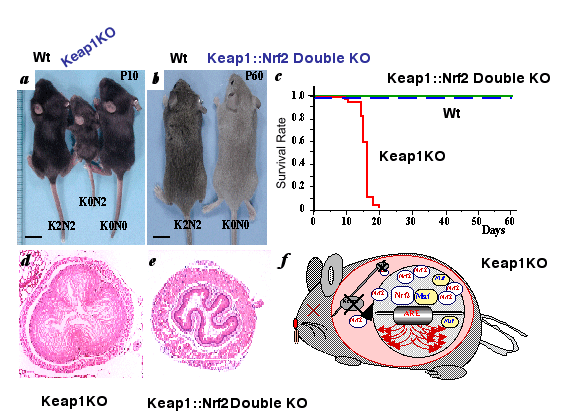
Keap1はNrf2の抑制性因子ですが,Keap1遺伝子破壊(ノックアウト)マウスでは,Nrf2が恒常的に活性化し防御遺伝子が発現することで,酸化ストレスにきわめて強くなることが予想されます.しかしながら,その予想に反して,Keap1ノックアウトマウスは生後3週間以内に死亡してしまいました(図7).詳細な解析の結果,Keap1ノックアウトマウスでは,食道または前胃が過角化により閉塞され,栄養飢餓により死亡することがわかりました.このKeap1ノックアウトマウスから,Nrf2遺伝子を欠失させた二重遺伝子破壊マウスを構築したところ,マウスの致死性は回避され正常に生育しました.これらの事実は,Keap1ノックアウトマウスではNrf2の恒常的活性化が致死を招いていたこと,さらにはNrf2とKeap1は真のパートナー因子であることをマウス個体レベルで証明したことになります. |
||||
 |
||||
|
図7 Keap1ノックアウトマウスの解析 |
||||
|
Wakabayashi N. et al. (2003) Nature Genetics 35: 238-244. Okawa H. et al. (2006) Biochem. Biophy. Res. Com. 339: 79-88. |
||||
| 2)Transgenic complementation rescue法によるドメイン解析 | ||||
|
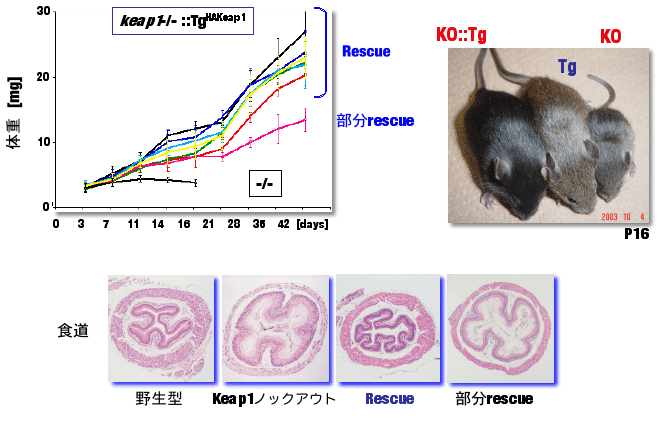
私たちは,試験管や培養細胞で得られたKeap1に関する知見を,マウス個体で検証するために,transgenic complementation rescue法を確立しました(図8).この解析では,Keap1ノックアウトマウスに対して,様々なKeap1変異体cDNAをトランスジェニック法で遺伝子導入し,致死性が回避できるかを指標に,そのドメインの機能評価を行います.野生型Keap1を発現させると,図8のように食道・前胃が過角化せず,致死が回避できました.一方,前述した酸化ストレスセンサーであるCys273とCys288変異体では,Nrf2を抑制することが出来ず,Keap1ノックアウトマウスの致死性を回避することが出来ませんでした.すなわち,Keap1のシステイン残基の重要性を,マウス個体で検証することが出来たわけです.今後,この解析ツールを武器に,Keap1の新たなメカニズムを発見したいと考えています. |
||||
 |
||||
|
図8 Transgenic complementation rescue法 |
||||
|
Suzuki-Yamamoto T. et al. 投稿中 |
||||
|
両刃の剣? Keap1-Nrf2システム |
||||
|
肺ガンにおけるKEAP1遺伝子変異の同定 |
||||
|
以上のように,Keap1-Nrf2システムは,酸化ストレス・親電子性物質に対する生体防御機構を制御するメインプレーヤーです.それでは,この制御機構の破綻がヒト疾患をもたらす可能性はあるのでしょうか?その相関を探るために,肺ガン検体のKEAP1とNRF2遺伝子変異を検索したところ,KEAP1のアミノ酸置換をもたらす遺伝子変異を同定しました.分子生物学的な解析から,この KEAP1変異体はNRF2を抑制することが出来ず,酸化ストレス防御遺伝子の恒常的発現をもたらしていました.つまり,そもそも生体防御に働くはずの遺伝子が肺ガン細胞では高く発現されているのです.酸化ストレス防御機構は,外来異物の解毒することで発ガンを予防しますが,他方でガン細胞の解毒代謝能を高めてしまい,ガンの進行を促進する負の局面を示しているのかもしれません.すなわち,Keap1-Nrf2システムによる生体防御機構は“両刃の剣”であり,その活性化と抑制化の制御機構の重要性を意味しています.現在,この遺伝子変異と肺ガン発症の相関を精力的に解析しています. (遺伝子変異解析は,国立がんセンターとの共同研究です.) |
||||
|
Padmanabhan B. et al. (2006) Mol. Cell 21:689-700. Hayes J. et al. (2006) Mol. Cell 21: 732-734. (上記論文の生理的意義を解説したコメンタリー) |
||||
|
Keap1-Nrf2システムの研究に興味を持たれた方は, 小林 聡(akirak@tara.tsukuba.ac.jp)までお問い合わせください. |
||||