寝ても寝ても眠いマウスの脳内メカニズム 単一遺伝子の単一アミノ酸が、1 日の睡眠時間と睡眠要求量・眠気を制御する
寝ても寝ても眠いマウスの脳内メカニズム 〜単一遺伝子の単一アミノ酸が、1 日の睡眠時間と睡眠要求量・眠気を制御する~
筑波大学国際統合睡眠医科学研究機構(WPI-IIIS)の本多隆利(研究当時、大学院生/日本学術振興会特別研究員DC1)、船戸弘正客員教授、柳沢正史機構長/教授らの研究グループは、遺伝子組換えマウスを用いた睡眠解析により、1日の睡眠時間と睡眠要求量(眠気)をコントロールする上で欠かせない単一遺伝子の単一アミノ酸を同定しました。このアミノ酸は線虫、ショウジョウバエ、マウス、ヒトまで進化的に広く保存されており、生物種を超えて睡眠・覚醒制御の中核を担うことが示唆されます。
本研究で樹立された過眠症モデルマウスが示す睡眠様態は、長時間の睡眠時間を確保しているにも関わらず、日中の眠気が軽減されない「特発性過眠症」の病態に共通しており、これら未だ原因不明の睡眠障害の分子メカニズムの理解に貢献できると期待されます。
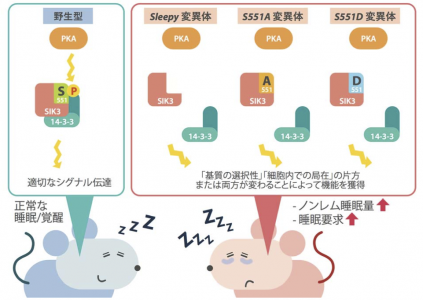
図 正常な睡眠/覚醒の制御には SIK3 のアミノ酸 S551 を介したリン酸化シグナル伝達が不可欠。
S551A・S551D・Sleepy(S551 を含むエクソン 13 欠損型)の3系統の変異型 SIK3 タンパク質では、リン酸化酵素PKA からの認識が減弱し、標的タンパク質の細胞内局在を司る 14-3-3 タンパク質との結合が失われる。その結果、SIK3 の基質特異性や細胞内局在が変化し、過眠の表現型に至ると示唆される。SIK3のS551が1日の睡眠量や睡眠要求量(眠気)を規定する上で重要な役割を担っている。
MEDIA RELEASE
A delegation from University of Tsukuba, including two members of Transborder Medical Research Center, travelled to Perth, Australia between 5-7th June, 2018 to expand relations with University of Western Australia (UWA) under the international UT Campus-in-Campus initiative.
The successful trip allowed Professors from University of Tsukuba to attend symposium events planned by UWA and the nearby Harry Perkins Institute of Medical Research, and to meet researchers and department members to discuss the potential for expanding collaboration and research opportunities.
The visiting University of Tsukuba delegates included: Professor Teruo Higashi from Global Affairs Office (ex University Vice President); Professor Yasunori Sasakura, Director of Shimoda Marine Research Center, Marine Science; Professor Chiaki Matsukura from Gene Research Center, Plant Science; Associate Professor Masafumi Muratani of Faculty of Medicine’s Transborder Medical Research Center Genome Biology Core and Mr Ian McMullen, also of the Faculty of Medicine’s Transborder Medical Research Center.

Photo: University of Tsukuba delegates meet Harry Perkins Institute of Medical Research representatives in Perth, Western Australia.
The delegation met with Heads of UWA’s International Affairs and Harry Perkins Institute of Medical Research, as well as the WA Oceans Institute, the Department of Plant Sciences and the Department of Sport Science.
The “Perkins” hosted an afternoon symposium and reception dinner, allowing Professors to highlight research capabilities and status of their work.
Japanese visiting Professors from University of Tsukuba were also able to deliver presentations promoting sharing of resources and showcased the high-level of research being conducted at University of Tsukuba. The symposium and casual dinner discussions afterwards offered an excellent opportunity to share knowledge and to discover untapped research collaboration opportunities.
Photo: University of Tsukuba’s Professor Teruo Higashi presents details of University of Tsukuba at the Harry Perkins Institute of Medical Research symposium in Perth, Western Australia.
Strong relationships were forged between Japanese delegates and WA representatives to help continuing relationships between University of Tsukuba, University of Western Australian and Harry Perkins Institute of Medical Research.
The delegation also had various one-on-one meetings and tours to view significant technology facilities for research related to a myriad of ongoing plant, marine and medical related studies within UWA and the Perkins Center. The visit to Perth signaled the beginning of an exciting new phase of collaborative research and education between University of Tsukuba and Harry Perkins Institute of Medical Research.
Photo: University of Tsukuba delegates meet the Oceans Institute at University of Western Australia in Perth, Australia.
Article by: Ian McMullen
Transborder Medical Research Center
Faculty of Medicine, University of Tsukuba, Ibaraki, Japan
筑波大学 医学医療系(生命科学動物資源センター) 濱田理人 助教、Tran Thi Nhu Mai 博士、白石莉紗子 修士、全孝静 修士、高橋智 教授らは、白血球の一種であるマクロファージが死細胞の除去機能を発揮し、難病に指定される全身性の自己免疫疾患を抑制するにあたっては、遺伝子発現を調節するたんぱく質MafBが必須であることを明らかにしました。
本研究グループは、マクロファージ内でMafBが死細胞や死細胞成分に活性化されたたんぱく質のシグナルを受け取り、補体C1q遺伝子の発現を制御することで、マクロファージが死細胞を認識することを明らかとしました。マウスの実験でMafBのはたらきを抑えると、マクロファージが死細胞を食べることができず、このマウスは自己免疫疾患になることを突き止めました。これらの結果は新しい自己免疫疾患治療法開発の基盤につながるものと期待されます。
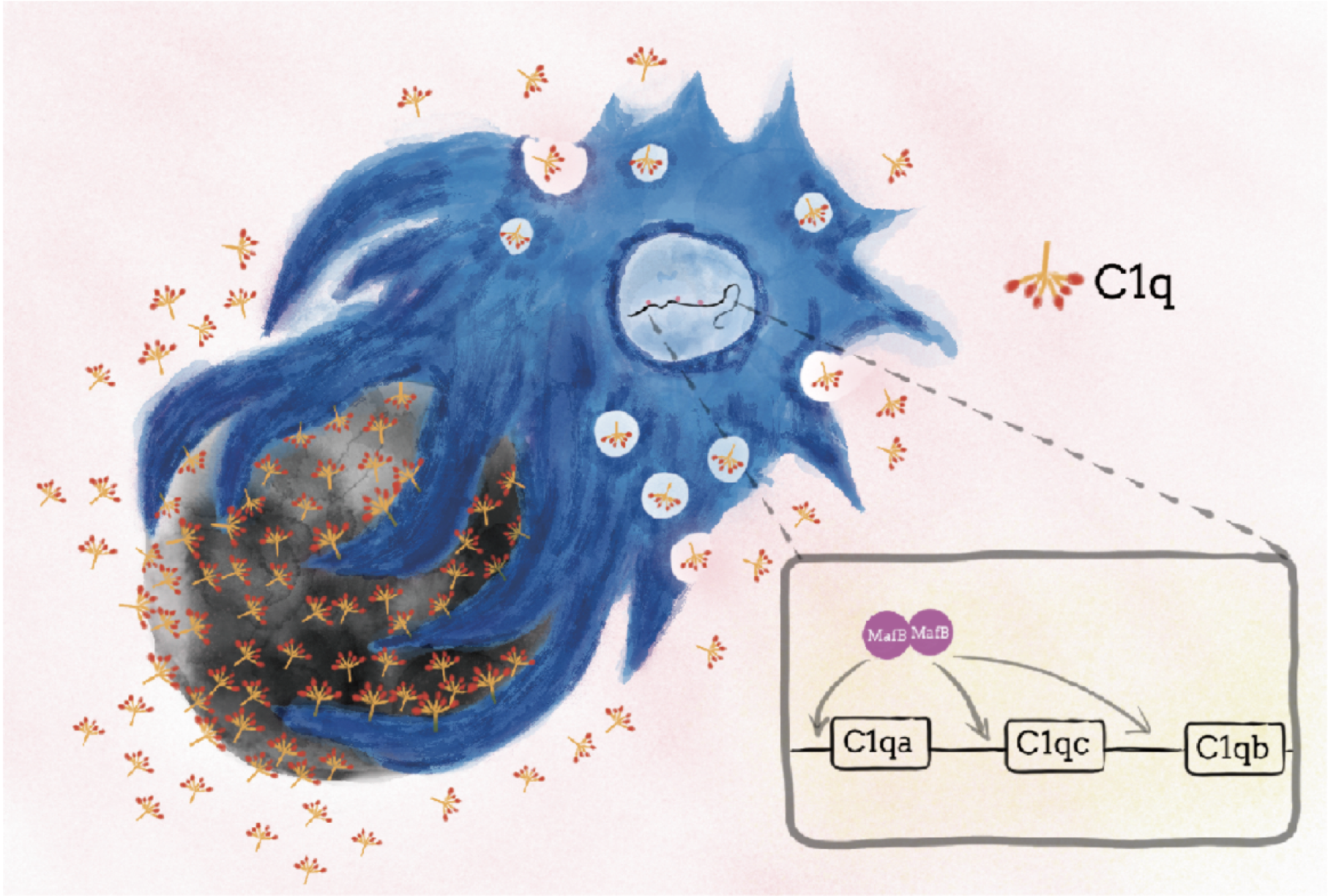
図 MafB はマクロファージの核内でC1q 遺伝子(C1qa, C1qc, C1qb) を転写制御する。マクロファージはC1q を直接細胞外に放出する。C1q は死細胞を認識し細胞表面に結合する。マクロファージはC1q が結合した死細胞を貪食する。
トランスボーダー医学研究センタープレゼンテーション
トランスボーダーメディカルリサーチセンターは、2017年9月26日に、つくば市の国際会議センターで開催される2017つくばグローバルサイエンスウィークで、プレゼンテーションを行いました。
Promotion of Basic Research in Life Science with Exit Strategy
The Transborder Medical Research Center held a sucessful morning of presentations at the 2017 Tsukuba Global Science Week in the International Congress Center, Tsukuba, Japan on 26 Sept, 2017.
The theme of presentation sessions was “Promotion of Basic Research with Exit Strategy”.
Special guest speakers included Professor Peter Leedman of Harry Perkins Institute of Medical Research, Perth, Australia, Professor Akiko Hata from University of California, San Francisco, USA and Professor Toru Natsume of Japan’s National Institute of Advanced Industrial Science and Technology (AIST). Trans-border Medical Research Center members Professor Satoru Takahashi and Dr Chris Hipolito also gave presentations on their recent work.
筑波大学医学医療系の千葉滋教授・坂田麻実子准教授らの共同研究グループは、特定の悪性リンパ腫でみられるRHOA遺伝子変異による異常なタンパク質がVAV1タンパク質と結合すること、これによりT細胞受容体シグナルを異常に活性化することを発見しました。
Image by CI Photos/Shutterstock
今回の研究では、G17V RHOA変異によって生じた異常なRHOAタンパク質がT細胞受容体シグナルを伝達する分子であるVAV1タンパク質と結合し、VAV1タンパク質の異常な活性化(リン酸化)を起こすことがわかりました。また、G17V RHOA変異がない場合の一部の場合では、VAV1遺伝子に異常があり、VAV1タンパク質の活性化を自己抑制する仕組みが壊れて異常な活性化がおきていることがわかりました。VAV1タンパク質の活性化は、T細胞受容体シグナルの活性化を起こし、これは他の血液がんで使用されているチロシンキナーゼ阻害剤により阻害されました。
以上の発見から、これまで治療が困難だった悪性リンパ腫の一部について、特異的なゲノム異常に基づく新規治療方法の創出が期待されます。
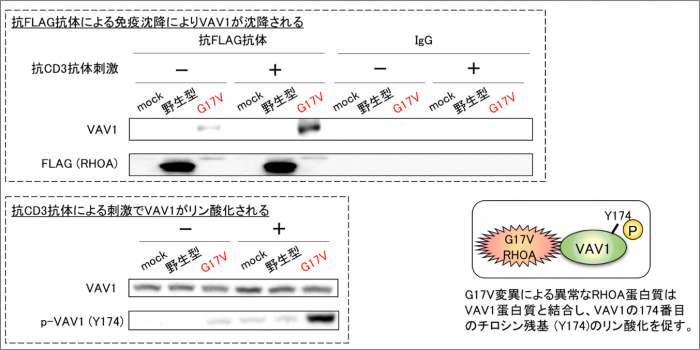
図 G17V変異による異常なRHOAタンパク質はVAV1タンパク質と結合し(上図)、活性化した(左下)。右下はまとめの図。
つくば トランスボーダー 医学研究センター国際 シンポジウム
プレスリリース
医学医療系トランスボーダー医学研究センターの国際シンポジウムを開催
平成29年4月1日付で,医学医療系の研究の強みを最大限に発揮し,世界トップレベルの研究を生み出す共同研究拠点として設置したトランスボーダー医学研究センターが,6月17日につくば国際会議場エポカルにおいて,国際シンポジウムを開催いたしました。
シンポジウムでは,文部科学省研究振興局の寺門成真学術機関課長に来賓として出席いただき,永田恭介学長 ,木越英夫副学長 (研究担当)にも出席いただきました。
シンポジウムは,永田学長の開会挨拶,寺門学術機関課長 の来賓挨拶,高橋智センター長からトランスボーダー医学研究センターの紹介が行われ,その後,4部構成で行われました。
第1部は「ゲノミクスとがん」,第2部は「プロテオミクスと新薬開発」,第3部は「代謝」及び第4部は「動物モデル」を題目として,下記の演者が最新の研究内容について講演されました。 シンポジウムには学内外の研究者160名以上にご参加いただき,会場がほぼ満席状態となるほど盛況に開催することができました。
また,会場からは質問が相次ぎ,予定時間を大幅に過ぎるなど講演への関心の深さと将来への期待を伺わせる有意義なシンポジウムとなりました。
第1部「ゲノミクスとがん」
村谷 匡史 先生(ゲノムバイオロジー分野),広川 貴次 先生(インホマティクス分野),Dr. Seong-Jin Kim(国立ソウル大学)
第2部「プロテオミクスと新薬開発」
川口 敦史 先生(感染体宿主動態分野),加藤 光保 先生(細胞動態科学分野),
Dr. Peter ten Dijke (Leiden University)
第3部「代謝」
福田 真嗣 先生(メタボロゲノミクス分野),松坂 賢 先生(エネルギー代謝科学分野),大石 由美子 先生(東京医科歯科大学)
第4部「動物モデル」
松本 正幸 先生(認知神経科学分野),三輪 佳宏 先生(イメージング分野),杉山 文博 先生(実験動物学分野),Dr. Tilo Kunath (University of Edinburgh)
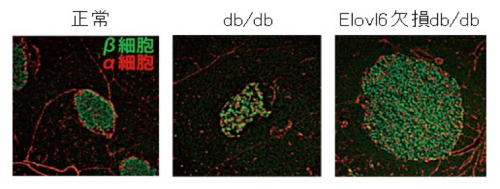
筑波大学 医学医療系 島野仁教授、松坂賢准教授らの研究グループは、肥満にともなう糖尿病の発症に脂肪酸伸長酵素Elovl6を介した脂肪酸バランスの変化が関与していることを発見し、Elovl6を阻害することで脂肪酸バランスを改善し、糖尿病の発症を抑制できることを明らかにしました。
肥満にともなう脂肪酸代謝の異常や臓器における脂肪酸の過剰蓄積が、糖尿病を引き起こすことはすでに知られていましたが、脂肪酸の質(種類や組成)の異常の意義は十分に解明されていませんでした。本研究グループは、パルミチン酸(C16:0)からステアリン酸(C18:0)への伸長を触媒する酵素Elovl6に着目し、糖尿病モデルマウスでこの酵素を欠損させると、インスリンを産生する膵臓のβ細胞の量とインスリン分泌が増加し、糖尿病の発症・進展が抑制されることを明らかにしました。本研究成果から、Elovl6の阻害や脂肪酸バランスの管理が、糖尿病の治療標的として有用であると考えられます。
図 正常マウス(左)、db/dbマウス(中央)、Elovl6欠損db/dbマウス(右)の膵臓ランゲルハンス島の免疫染色像。db/dbマウスに比べてElovl6欠損db/dbマウスの膵臓ランゲルハンス島ではインスリンを合成・分泌するβ細胞(緑)の量が増加している。
→ Diabetes 2017 Apr; db161277. https://doi.org/10.2337/db16-1277 (英語/English)
→ PDF資料はこちら(日本語)
乳がんの腫瘍形成・転移形成における新たな仕組みの解明 ~トリプルネガティブ型乳がんの治療標的を求めて~
乳がんの腫瘍形成・転移形成における新たな仕組みの解明
~トリプルネガティブ型乳がんの治療標的を求めて~
筑波大学 医学医療系 加藤光保教授、沖田結花里研究員らの研究グループは、ウプサラ大学 Carl-Henrik Heldin教授、早稲田大学 仙波憲太郎教授、山梨大学 齋藤正夫教授らとの共同研究により、乳がんの発生や転移に関わる新たな仕組みを解明しました。
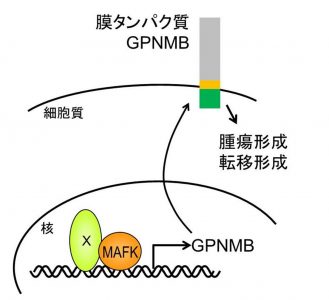
加藤教授らは、発がんへの関与が広く知られている増殖因子TGF-βによって発現が誘導される転写因子MAFKがトリプルネガティブ型乳がんで高く発現していることを新たに発見しました。さらに、MAFKおよびそのMAFKによって発現が上昇することが判明した膜タンパク質であるGPNMBに着目し、培養細胞やマウスを用いて、これまで知られていたがん遺伝子とは異なる働き方でMAFKやGPNMBが足場非依存性増殖の誘導、乳がんの発生、浸潤や転移に関与することを明らかにしました。
図 転写因子MAFKは、膜タンパク質GPNMBの発現を誘導することで、乳がんの腫瘍形成と転移形成に関与する。
→ Science Signaling DOI: 10.1126/scisignal.aak9397 (英語/English)
→ PDF資料はこちら(日本語)
脳梗塞の炎症が収束するメカニズムを解明 -- 白血病治療薬による脳梗塞の悪化阻止を確認 --
脳梗塞の炎症が収束するメカニズムを解明 ~白血病治療薬による脳梗塞の悪化阻止を確認~
JST 戦略的創造研究推進事業において、慶應義塾大学 医学部の七田 崇 講師、吉村 昭彦 教授、筑波大学 医学医療系の高橋 智 教授らは、脳梗塞後の炎症反応を収束させる遺伝子群を新たに発見し、これらの遺伝子群を制御することで炎症を早く収束させて、神経症状を改善できることを動物実験で明らかにしました。
脳梗塞は寝たきり状態や重篤な後遺症の主な要因ですが、有効な治療法は限られています。脳梗塞後に起こる炎症は、脳浮腫や神経症状の悪化の原因となるため、炎症を早く収束させる治療法の開発が期待されていますが、炎症収束のメカニズムは明らかではありませんでした。
本研究グループは、炎症の収束に関わる遺伝子群(Msr1、Marco、Mafb)の発見に成功し、これらの遺伝子群が、壊死した脳組織で産生された炎症惹起因子を効率的に排除することを発見しました。さらに白血病治療薬のタミバロテンが、これらの遺伝子群の発現を増加させることを見いだしました。脳梗塞を起こしたマウスにタミバロテンを投与すると炎症の収束が早まり、神経症状が改善されました。
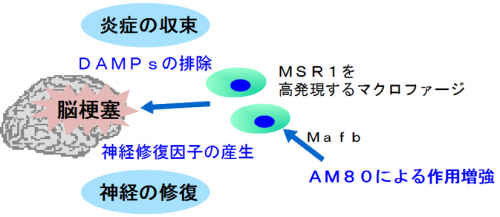
図 本研究の概要
脳梗塞において、MSR1を高発現するマクロファージはDAMPsを効率よく排除し、神経栄養因子を産生する修復細胞として機能する。AM80を投与するとMafbを介して、マクロファージのMSR1の発現を増強して脳梗塞後の炎症の収束を加速させる。
→ Nature Medicine doi:10.1038/nm.4312 (英語/English)
→ PDF資料はこちら(日本語)
Mafb prevents excess inflammation after ischemic stroke by accelerating clearance of danger signals through MSR1 - Nature Medicine doi:10.1038/nm.4312