大学院
癌幹細胞研究
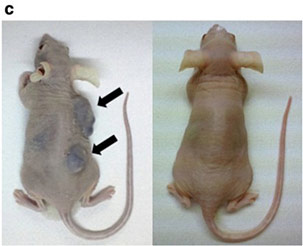
大腸癌・胃癌・膵癌・肝癌は肺癌に続いてがんによる死亡数の多い疾患です。消化器内科では多くの診療科と力を合わせて、日々の癌治療を行っていますが、進行癌では根治を目指すことは容易ではありません。たとえ抗がん剤がよく効いても、多くの場合その効果は一時的です。その理由の1つは、腫瘍に含まれるがん細胞の不均一性にあります。一人の患者さんであっても、がん細胞の特性は細胞によってまちまちで、抗がん剤に効きやすい細胞もあれば効きにくい細胞もあります。近年、がん細胞は必ずしも全ての細胞が腫瘍を形成するわけではないことが分かってきました。様々ながん細胞を生み出し腫瘍形成の根源と考えられる細胞を、癌幹細胞Cancer stem cells(CSCs)と呼びます。一般的にCSCsは治療抵抗性であり、がんの発症や再発・転移に関わっていると考えられています。従って、CSCsを制御することは、がん治療を考える上で非常に重要です。
我々は、理化学研究所バイオリソースセンターBRC細胞材料開発室(中村幸夫室長)との共同研究により、CSCsの基礎研究を行っております。BRCにはがん患者さんから提供されて細胞株として樹立された数多くのがん細胞を扱っていますが、培地の上で培養されるがん細胞においても、CSCsの特性を有する細胞集団とそうでない集団が含まれていることが様々な研究で報告されています。我々は、肝癌細胞株Li-7細胞において、がん細胞の細胞膜の表面に発現しているCD13とCD166というタンパクをマーカーとして、CSCs分画を明らかとしました。すなわち、CD13陽性かつCD166陰性のLi-7細胞はCSCsの特性を有し、CD13陰性かつCD166陽性のLi-7細胞はそうした特性を失っていることを見いだしました(Yamada T, et al. BMC Cancer 2015)。
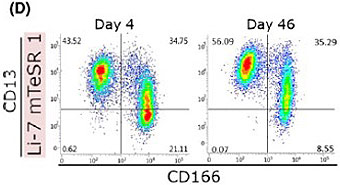
CSCを標的とした治療を考えた場合、前者の集団を死滅させるような治療薬の見つけることが重要です。しかしながらLi-7細胞のCSCs集団は培養していると徐々に非CSCs細胞へと分化する(置き換わっていく)ため、維持することが容易ではありません。そこで、ノーベル賞で有名な山中先生のiPS細胞を培養する条件を用いてLi-7細胞を培養したところ、CSCs集団を維持できることが分かりました(Sato Y, Yamada T, et al. Cancer Science 2019)。
この培養系を用いてCSCと非CSCにおける遺伝子発現の比較により、CSCの分化を制御している遺伝子群が同定されました(論文投稿予定)。
今後は、これまでの知見をもとに新たな治療開発や臨床検体を用いた解析などを検討しています。

