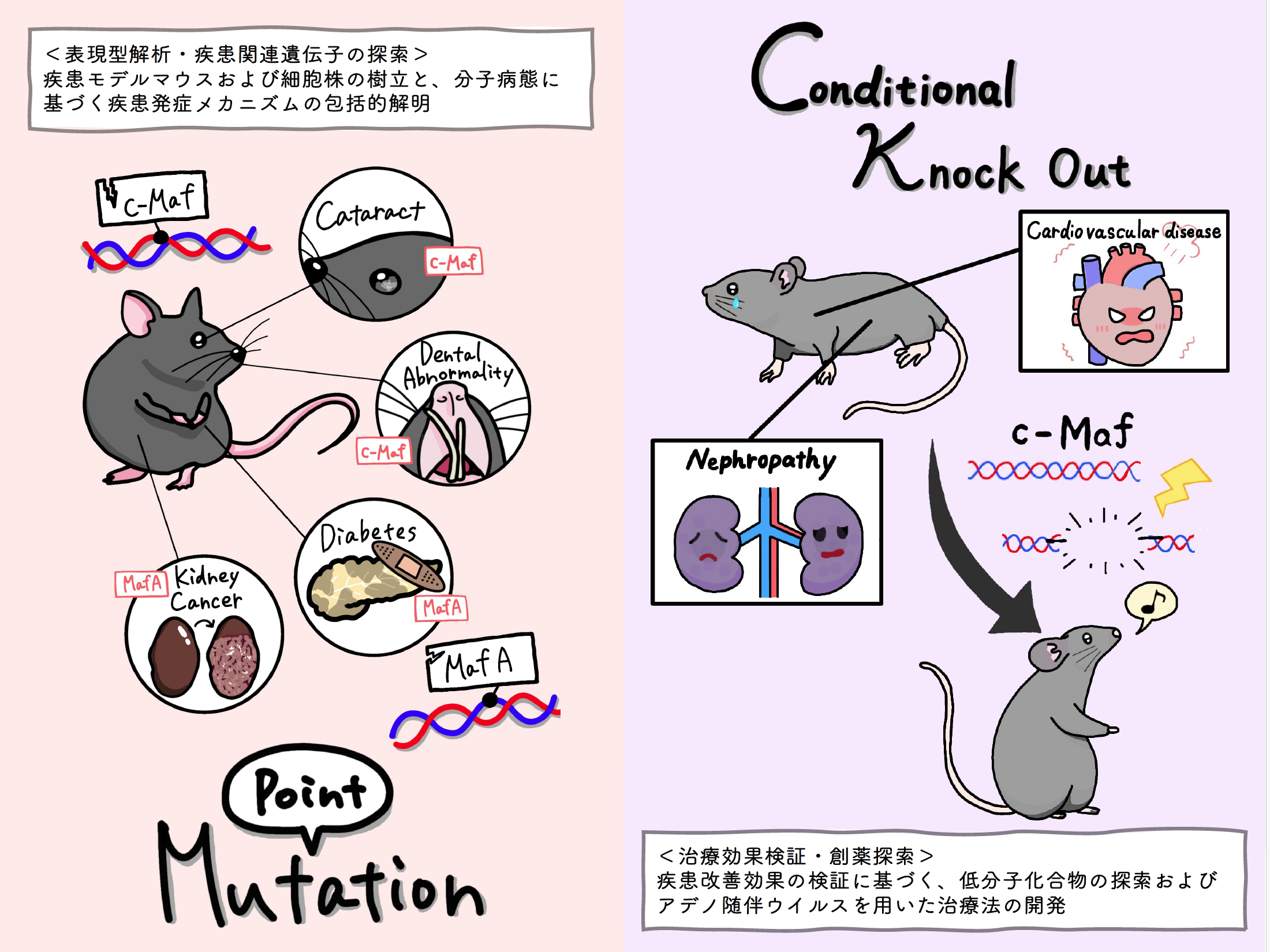
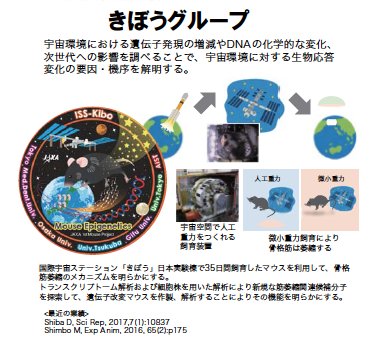
1) Fujino M, Morito N, Hayashi T, Ojima M, Ishibashi S, Kuno A, Koshiba S, Yamagata K, Takahashi S. Transcription factor c-Maf deletion improves streptozotocin-induced diabetic nephropathy by directly regulating Sglt2 and Glut2. JCI Insight. 22;8(6):e163306, 2023
2) Fujino M, Ojima M, Ishibashi S, Mizuno S, Takahashi S.Generation and mutational analysis of a transgenic murine model of the human MAF mutation. American Journal of Medical Genetics, Part A. 191(7):1878-1888, 2023
3) Mitsunori Fujino, Masami Ojima, and Satoru Takahashi.Exploring Large MAF Transcription Factors: Functions, Pathology, and Mouse Models with Point Mutations. Genes. 14(10),1883, 2023
4) Fujino M, Tagami A, Ojima M, Mizuno S, Abdellatif AM, Kuno A, Takahashi S. c-MAF deletion in adult C57BL/6J mice induces cataract formation and abnormal differentiation of lens fiber cells. Experimental Animals. 24;69(2):242-249, 2020 |