A01班公開シンポジウム報告
-「知」の構築原理解明に向けた新たなる橋頭堡の建設-
山本融(理化学研究所・再生・発生科学総合研究センター)
班長の桝先生から突然のお電話。「ありゃあ、しまった!何か出し忘れていたものがあったかな?」と、冷や汗タラタラの私に「公開シンポA01班分のレポートを出すように」とのお言葉。ホッとした心の弛みで「ハイハイハイわかりました」と3つ返事でお引き受けしたものの、落ち着いて考えてみると「さて、いったい私に何ができる?」あわてて諸先生方の過去のレポートをあらためて拝見させていただくと、格調高い言葉での鋭いレビューがならぶ。しかも今回は先端脳5年分の総括である班長報告が入っている。「おい、お前さんのガラじゃあねえぞ、こりゃあ。」さあ、いったいどうしよう?とりあえず、まずは素直な感想から。
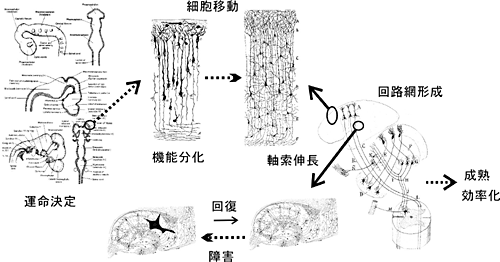
A01班の役割は、目標達成型の本特定領域研究「先端脳」の中で、我々の意識の座である「脳」がどのように構築されていくのか、また、構築された脳の機能維持とその障害時における再生に重要な役割を果たし得る神経幹(前駆)細胞群の存在がどのように制御されているのかを探ること、いってみれば「知」を構成し維持するインフラの構築原理を明らかにすることにありました。しかし、何しろ大きなテーマです。様々なアプローチで同じ目的に向かって進んでいる研究が多数ある中で、本班では、従来の知見・情報からは比較的に自由な地点に出発点を定め、それらからの直接の演繹が困難であった知見を新たに引き出していこうとする意欲が強い研究が多く集められたように思います。その結果、今後の新たな発展のための橋頭堡となりうるoriginalityの高い知見が多数生み出されることになりました。今回シンポジストとしてお話になった貝淵先生が進められた、CRMP-2をkey
moleculeとする神経細胞における極性と軸索伸長の制御についての分子機構論の著しい進展は、そうして得られた収穫の代表といえましょう。Rho
kinaseの脳内における新規基質としてCRMP-2を単離し、あらためて解析を加えた結果、CRMP-2は海馬神経細胞において軸索遠位部に選択的に濃縮され、その過剰発現により本来一本であるはずの軸索が複数本誘導されること、ついでCRMP-2の結合因子を探索した結果チューブリンのheterodimerに結合して微小管の重合を促進することを明らかにし、同じくNumbと結合し、接着分子であるL1のendocytosisを促進することで軸索伸長に促進的に働くことを示されました。さらにCRMP-2の514位のTがGSK3-βによってリン酸化され、これによりチューブリンへの結合性が減弱すること、逆にGSK3-βの活性を抑制すると神経軸索がやはり複数本伸長し、さらにCRMP-2の514位のTをAに置換した非リン酸化型の変異体ではその複数本の軸索を形成する活性がさらに増強されること、などを相次いで見いだし、PI3
kinaseの活性化から軸索の伸長に至るメカニズムの一端をあれよあれよという間に説き明かしてしまいました(PI3K -> PIP3
-> Akt -| GSK3β-| CRMP-2 - tubulin -> axonal growth)。
|
A proposed prosomeric model of the forebrain
(Trends Neurosci. 26, 473, 2003)
|
さらに、桝先生の総括にしたがってA01班の主な収穫をあげてみましょう。根岸先生はRhoファミリーGタンパク質群の機能に着目し、RhoGからはNGFによる神経突起伸長をもたらす分子メカニズムにおけるミッシングリンクであったElmoを同定することでTrio-RhoG-Elmo-Dock180-Racのカスケードの全容を明らかにし、さらにRnd1の解析からはR-Ras
GAPがSema-Plexin系における軸索反発作用の普遍的な情報伝達機構であることを明らかにされました。神経突起伸長と軸索の退縮という神経細胞の動態における異なる普遍的な情報伝達メカニズムが一つの研究チームの同質のアプローチから相次いで明らかにされたことになります。佐藤先生は大脳皮質脳室帯に選択的に発現する因子を単離し、その結合因子を探索した結果アクチン結合タンパクであるFilaminAと結合することを見いだし、これをFILIPと名付けました。解析の結果、おもしろいことにFILIPは結合相手であるFilaminAの分解を促進することで脳室帯から皮質への細胞移動の開始を負に制御していることが明らかとなり、皮質形成時における特徴的な細胞動態を規定している分子機構の一端を示されました。それぞれの神経細胞運命の決定は転写因子群の発現により規定されていきますが、小椋先生はショウジョウバエの転写因子iroquoisの脊椎動物ホモログであるIrxファミリーの単離と解析から、isthmus後方でのFGF8による小脳誘導が、MAP
kinaseを経て、小脳の原基であるrhombic lipに発現するIrx2をリン酸化することでIrx2の転写調節能を抑制から活性化へと反転させることにより行われることを明らかにしました。つまり、Irx2が小脳分化へのcompetencyを担っており、FGF8によりその活性化がおこなわれることで小脳構築への引き金が引かれるというシステムの存在が示されたわけです。また、古川先生は網膜視細胞が網膜幹細胞から分化する際にOtx2の発現が必要であることを示し、中福先生は神経前駆細胞における運動神経への運命決定がOlig2とNgn2のcombinationにより規定されることを示しました。
|
|
Cajal’s diagram of sensory pathways
(Texture of the Nervous System, Madrid, 1904)
|
また、これに加えて、中福先生は、成体の神経組織に内在する神経前駆細胞の障害修復への関与を、全脳虚血により誘導される海馬CA1錐体ニューロン障害をモデルに検証されました。その結果、虚血によるCA1ニューロンの脱落後、その回復がわずかながら見られること、この時神経前駆細胞の増殖因子として知られるFGF2とEGFを投与するとCA1ニューロンの数が著明に増加し、これらが確かに内在性の神経前駆細胞に由来すること、再生したCA1ニューロンは障害前のCA1ニューロンと同等の役割を果たして神経回路を機能的に再構築できることを示し、成体脳の潜在的な再生能力の存在を明らかにされました。この我々に本来備わった能力を活用するためには、神経幹(前駆)細胞の活性化、すなわちその増殖・分化の制御機構を理解することが重要です。もう一人のシンポジストである岡野先生は、neurosphereの性質を上手に使ったシステム(patent
pending!)を構築して、こうした神経幹細胞増殖関連因子のスクリーニングをおこない、ガレクチン-1にその活性があることを同定し、報告されました。この優れてユニークな知見は、その同定がほぼ終了しているらしいガレクチン-1受容体の解析とあわせて、神経幹細胞の増殖制御機構のみならず、マクロファージを介した間接作用であることが示唆されている軸索伸長活性をはじめとしたガレクチン-1におけるその他の多岐にわたる生理活性の分子機構解明、さらには再生医療におけるその応用までをも視野に入れた大きな一歩となることが期待されます。
本研究領域を含む3領域のあとを承けて「統合脳」5領域が発足します。我々「インフラ系」は核となる組織を失うことになりますが、ここ「先端脳」で得られた成果を橋頭堡に、新領域でさらにご活躍になる先生方も多いものと思います。最後に、新参者(数年前までは転写制御の分子メカニズムについて研究をしていました)の萌芽的な研究を支えていただけたことに深く感謝して、本稿を終えたいと思います。
|