統合医科学研究部門
細胞動態科学分野
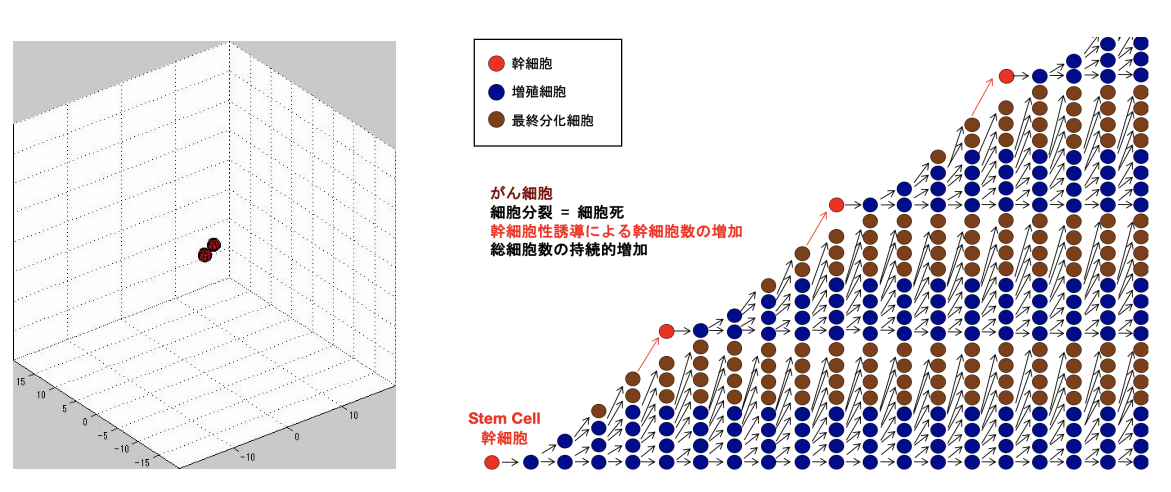
がん細胞の持続的増殖
造血組織、表皮組織、腸粘膜上皮などの正常組織は、持続的に増殖し続けている細胞集団によって維持されているが、これらの組織を構成している細胞の総数は動的平衡が保たれ一定の数になっている。これらの正常組織は、間欠的に分裂増殖する組織幹細胞に由来し、連続して細胞分裂周期を回る一過性増幅細胞となり数を増やし、それらが最終分化して機能した後に寿命をむかえて細胞死に至る。この様な正常組織の生理的再生の機構は、この機構そのものが組織を構成する細胞総数を一定に保つロバストな制御機構になっている。この機構の破綻によって生じるがん細胞集団が持続的に総細胞数を増加し続ける様になる機序について検討し、休眠がん細胞の一部が幹細胞の特性を獲得する幹細胞性誘導がその本質的に重要な機序である可能性を示唆している。現在、この幹細胞性誘導が起こる分子機構について解析するとともに幹細胞性誘導を標的とした新たながん治療方法の開発により、再発のないがん治療の確立を目指している。
関連研究論文
GPNMBについて
Okita Y, Kimura M, Xie R, Chen C, Shen LTW, Kojima Y, Suzuki H, Muratani M, Saitoh M, Semba K, Heldin C-H, Kato M. The transcription factor MAFK induces EMT and malignant progression of triple-negative breast cancer cells through its target GPNMB. Science Signal. 10 (474), pii: eaak9397, 2017. doi: 10.1126/scisignal.aak9397. PMID: 28400538
Chen C, Okita Y, Watanabe Y, Abe F, Fikry MA, Ichikawa Y, Suzuki H, Shibuya A, Kato M. Glycoprotein nmb is exposed on the surface of dormant breast cancer cells and induces stem cell-like properties. Cancer Res. 78(22): 6424-6435, 2018. doi: 10.1158⁄0008-5472.CAN-18-0599.
Okita Y, Chen C, Kato M. Cell-surface GPNMB and induction of stemness. Oncotarget. 9(99):37289-37290, 2018. doi: 10.18632/oncotarget.26472. (Editorial)
Xie R, Okita Y, Ichikawa Y,Mohammed FA, Huynh Dam KT, Tran SPT, Kato M. Role of the kringle-like domain in Glycoprotein NMB for its tumorigenic potential. Cancer Sci. 110(7): 2237-2246, 2019. doi: 10.1111/cas.14076. PMID: 31127873
PMEPA1/TMEPAI
Watanabe Y, Itoh S, Goto T, Ohnishi E, Inamitsu M, Itoh F, Satoh K, Wiercinska E, Yang W, Shi L, Tanaka A, Nakano N, Mommaas AM, Shibuya H, ten Dijke P and Kato M. TMEPAI, a transmembrane TGF-ß -inducible protein, sequesters Smad proteins from active participation in TGF-ß signaling. Mol Cell. 37: 123-134, 2010.
Nakano N, Itoh S, Watanabe Y, Maeyama K, Itoh F, and Kato M. Requirement of TCF7L2 for TGF-ß -dependent transcriptional activation of the TMEPAI gene. J Biol Chem. 285: 38023-38033, 2010.
Vo Nguyen TT, Watanabe Y, Shiba A, Noguchi M, Itoh S and Kato M. TMEPAI/PMEPA1 enhances tumorigenic activities in lung cancer cells. Cancer Sci. 105: 334-341, 2014. doi: 10.1111/cas.12355. Epub 2014 Feb 18. PMID:24438557.
Azami S, Vo Nguyen TT, Watanabe Y and Kato M. Cooperative induction of transmembrane prostate androgen induced protein TMEPAI/PMEPA1 by transforming growth factor-ß and epidermal growth factor signaling. (*equal contribution) Biochem Biophys Res Commun. 456: 580-585, 2015. doi: 10.1016/j.bbrc.2014.11.107. PMID: 25482449
Nakano N, Kato M, Itoh S. Regulation of the TMEPAI promoter by TCF7L2: the C-terminal tail of TCF7L2 is essential to activate the TMEPAI gene. J Biochem. 159: 27-30, 2016. doi:10.1093/jb/mvv117. PMID: 26590303.
Wardhani BWK, Puteri MU, Watanabe Y, Louisa M, Setiabudy R, Kato M. Knock-out transmembrane prostate androgen-induced protein gene suppressed triple-negative breast cancer cell proliferation. Medical J. Indonesia 26(3): 178-182, 2017.
Amalia R, Abdelaziz M, Puteri MU, Hwang J, Anwar F, Watanabe Y, Kato M. TMEPAI/PMEPA1 inhibits Wnt signaling by regulating β-catenin stability and nuclear accumulation in triple negative breast cancer cells. Cell Signal. pii: S0898-6568(19)30059-2, 2019. doi: 10.1016/j.cellsig.2019.03.016. PMID: 30890370
Abdelaziz M, Watanabe Y, Kato M. PMEPA1/TMEPAI knockout impairs tumor growth and lung metastasis in MDA-MB-231 cells without changing monolayer culture cell growth. J Biochem. 165(5): 411-414, 2019. doi: 10.1093/jb/mvz022. PMID: 30873542
Wardhani BWK, Puteri MU, Watanabe Y, Louisa M, Setiabudy R, Kato M. Decreased sensitivity of several anticancer drugs in TMEPAI knockout triple-negative breast cancer cells. Medical J. Indonesia 28: 110-115, 2019. doi: 10.13181/mji.v28i2.2687
Puteri MU, Watanabe Y, Wardhani BWK, Amalia R, Abdelaziz M, Kato M. PMEPA1/TMEPAI isoforms function via its PY and Smad interaction motifs for tumorigenic activities of breast cancer cells. Genes Cells, 25(6): 375-390, 2020. DOI: 10.1111/gtc.12766 PMID: 32181976
TSC22ファミリーについて
Zheng L, Suzuki H, Nakajo Y, Nakano A, Kato M. Regulation of c-MYC transcriptional activity by transforming growth factor-beta 1-stimulated clone 22. Cancer Sci. 109:395-402, 2018. doi: 10.1111/cas.13466. Epub 2018 Jan 9. PMID: 29224245
Tran SPT, Hipolito CJ, Suzuki H, Xie R, Huynh Dam KT, ten Dijke P, Terasaka N, Goto Y, Suga H, Kato M. Generation of non-standard macrocyclic peptides specifically binding TSC-22 homologous gene-1. Biochem Biophys Res Commun. 516(2): 445-450, 2019. doi: 10.1016/j.bbrc.2019.06.035. PMID: 31227214
Zhang X, Koga N, Suzuki H, Kato M. Promotion of cellular senescence by THG-1/TSC22D4 knockout through activation of JUNB. Biochem Biophys Res Commun. 522(4):897-902, 2020. doi: 10.1016/j.bbrc.2019.11.145. PMID:31806366
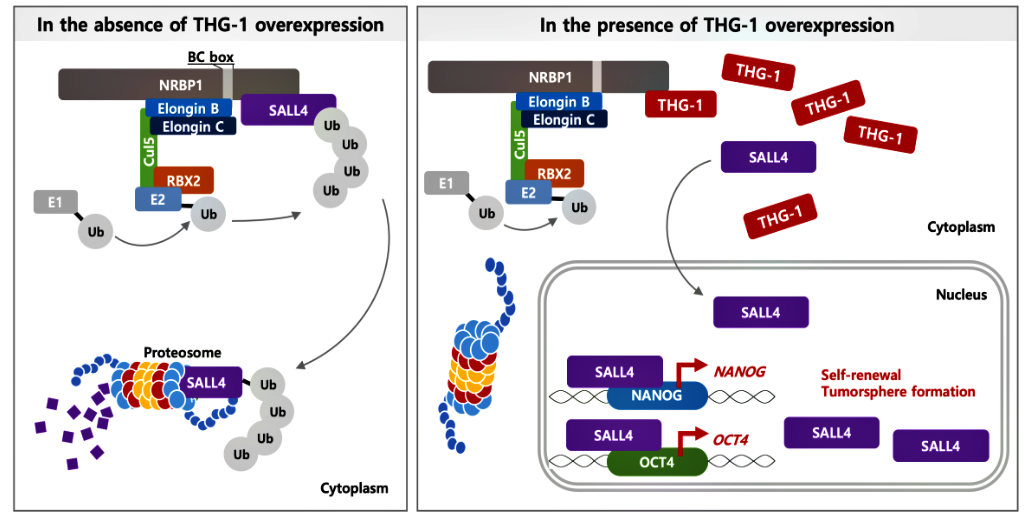
Hwang J, Haque MA, Suzuki H, ten Dijke P, Kato M. THG-1 suppresses SALL4 degradation to induce stemness genes and tumorsphere formation through antagonizing NRBP1 in squamous cell carcinoma cells. Biochem Biophys Res Commun. 523(2):307-314, 2020. doi:10.1016/j.bbrc.2019.11.149. PMID:31864704
主任研究員
加藤光保 教授

主任研究員
研究分野の外部ウェブサイト